-
当今社会,化石燃料的日渐枯竭以及其燃烧对环境的破坏引起了世界各地科学家和政界的重视,寻找新的清洁燃料替代化石燃料势在必行[1-2]。生物燃料作为新一代可再生清洁燃料是大势所趋。乙醇作为第一代生物燃料,因其诸多优点被广泛用作汽油的替代燃料或发动机含氧燃料添加剂[3-4]。但乙醇的低热值、高蒸发潜热和弱扩散性不利于其在发动机上应用[5]。因此可以在乙醇发动机中添加一定比例的氢气。氢的来源广、点火能量低、燃烧速率高、淬火距离短等特性[6-8]对促进缸内燃料均匀性,改善湍流燃烧具有重要作用,有助于减少废气的㶲和基于热的㶲传递[9-10]。加氢乙醇发动机是未来发展的必然趋势[11],因此,开展乙醇氢气预混火焰燃烧特性的影响研究非常有必要。
层流燃烧速度(Laminar Burning Velocity,LBV)是表征燃料和氧化剂预混料在绝热条件下稳定的平面火焰传播的基本燃烧属性[12]。层流燃烧速度的研究有助于提高我们对各种燃烧现象的理解[13]。它还促进了新的动力学模型的发展及其后续对各种目标应用的改进。因此,测定预混火焰在不同操作条件下的层流燃烧速度可为化学反应分析提供依据[14]。
近年来,国内外学者对氢气混合燃料的层流燃烧进行了大量研究。Chen等[15]分析了正癸烷/氢对正癸烷层流燃烧特性的影响,发现H2可以改善层流燃烧特性,其化学作用促进了正癸烷的层流燃烧速度和绝热火焰温度,物理作用抑制了正癸烷的化学反应导致净放热速率降低;Oppong等[16]研究了乙酸乙酯/氢气/空气在各工况时的预混燃烧特性,发现当氢气浓度和初始压力增加时,火焰厚度减小或曲率效应是导致乙酸乙酯/氢气/空气预混火焰不稳定和细胞化的主要原因;徐一博等[17]在定容燃烧试验系统内研究了掺氢比和初始压力对汽油层流燃烧特性的影响,发现相同当量比情况下,氢气的加入使层流燃烧速度提高;随着掺氢比的提高层流燃烧速度峰值逐渐向浓混合气区移动,氢气的加入改变了混合燃料的火焰不稳定性变化趋势;Wang等[18]在各种工况下研究了氢气-甲烷-乙醇球形膨胀火焰的不稳定性,研究了流体动力效应和热扩散效应对火焰固有不稳定性的影响。发现在较高压力下火焰更容易发生不稳定,随着乙醇含量的上升,贫混合气火焰稳定性增加,而富混合气火焰的不稳定性出现早发性;闫晨朝等[19]利用数值模拟方法,采用Chemkin软件对氢气-乙醇-空气的层流燃烧速度、密度比、绝热火焰温度、火焰厚度等进行分析,发现预混火焰的层流燃烧速度在所有初始条件下峰值出现在当量比φ=1.2左右,并且随着氢气含量的增加,峰值向富燃侧移动。密度比和绝热火焰温度都随着当量比的增大而呈现先升后降的变化趋势,而火焰厚度则表现出相反的规律。
综上所述,氢气与其他燃料混合的研究从未停止,而氢气乙醇燃气燃烧的研究还不够完善,为了更好地解决乙醇氢气混合物层流燃烧研究缺乏的问题,需要更多的实验研究,并为燃料的使用形成可靠的研究框架。压力和当量比是影响燃烧过程的关键性参数,能够直接影响燃烧效率、能量利用和安全性等方面。鉴于上述分析,本研究基于定容燃烧系统,在初始温度为370 K,氢气比例为50%,初始压力为1 bar、2 bar、4 bar,当量比为0.7~1.4条件下研究了当量比和压力对乙醇氢气预混火焰的层流燃烧特性的影响,同时,模拟了乙醇氢气混合物自由传播的一维平面火焰,分析了氢气对乙醇燃烧层流燃烧速度的动力学影响。
-
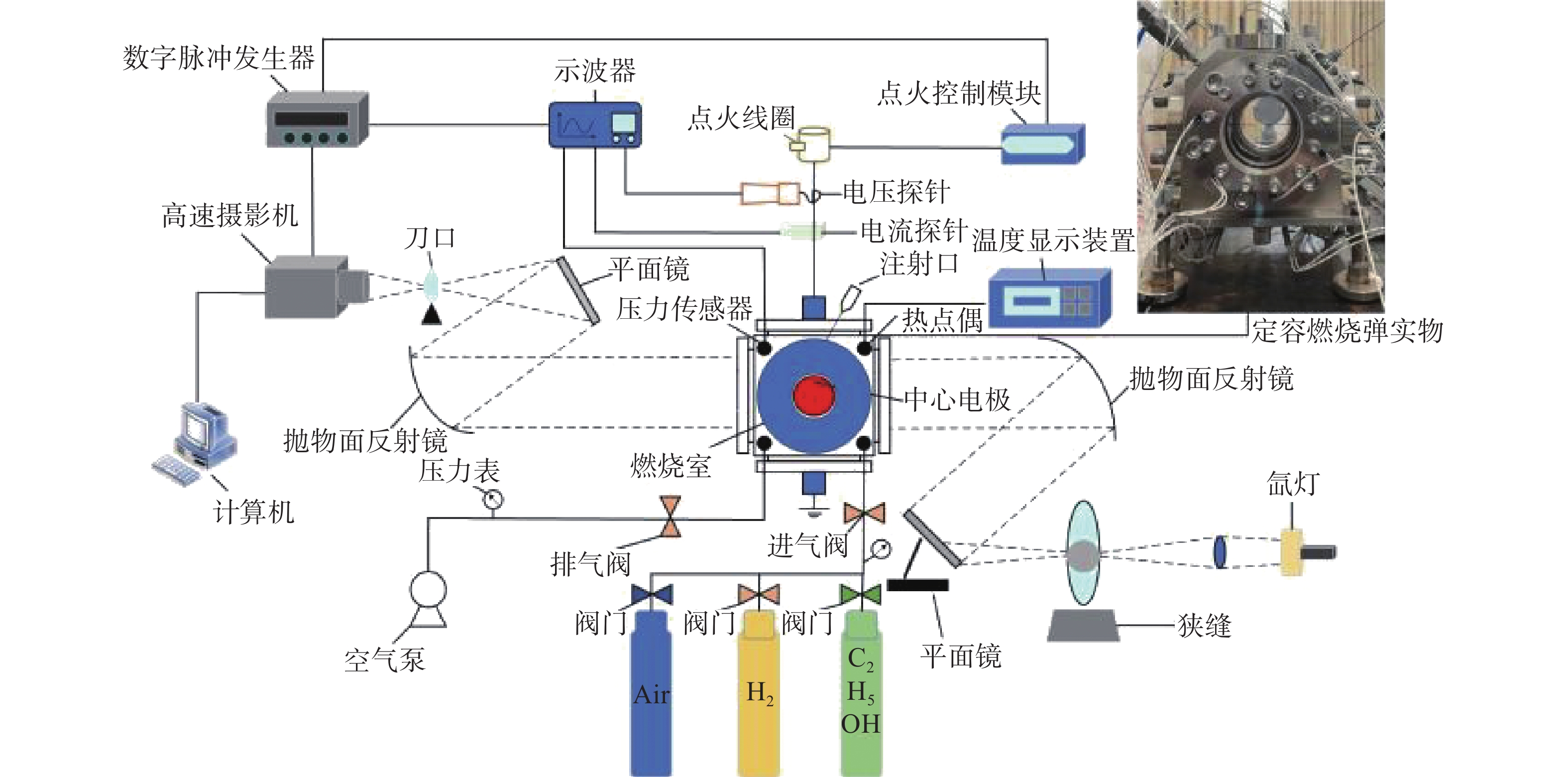
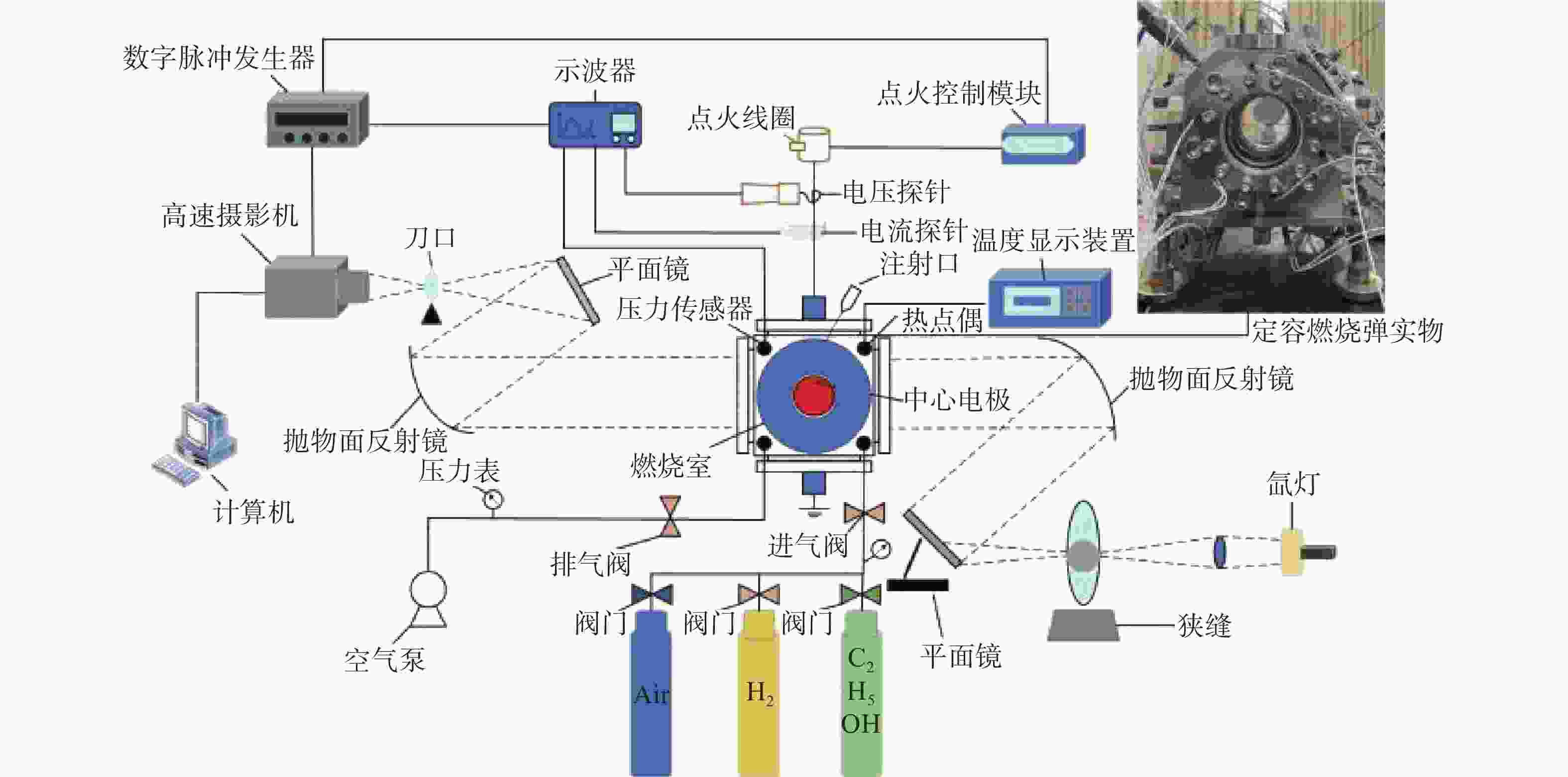
本次研究是用球形火焰法来测量层流火焰燃烧速度,图1给出了实验装置原理图。主要由定容燃烧弹(Constant Volume Combustion Chamber,CVCC)、高速摄像机、点火系统、数据采集系统和进排气系统组成。CVCC为立方体结构,容量为2.067 L,内部半径为79.02 mm,燃烧室两侧装有石英玻璃窗,具有耐高温和高透光的优点,并可提供直径90 mm的光学通道。在CVCC系统中,PID控制加热电极加热,型号为WRNK-234的K型热电偶(精度在±0.75%范围内)和压力表(
0.0001 MPa)测定初始温度和压力。PID控制器与加热器均匀分布于筒壁上(总功率为2.160 kW),确保CVCC内部温度均匀分布。混合物在CVCC中使用2个直径0.4 mm的对置电极点燃,连接至点火控制系统和点火线圈,协同实现点火过程。点火后,形成的球形火焰向外扩散,其传播过程通过纹影系统记录。球形火焰传播图像由高速摄像机拍摄(记录频率为12800 FPS,分辨率为1024 ×1024 Pixels)。 -
本实验研究内容的总化学方程式为:
$$ \mathrm{C}_x\mathrm{H}_y\mathrm{O}_{\textit z}+\left(x+\frac{y}{4}-\frac{{\textit z}}{2}\right)\mathrm{O}_2-x\mathrm{C}\mathrm{O}_2-\left(\frac{y}{2}\right)\mathrm{H}_2\mathrm{O}=0 $$ (1) 由式(2)-式(5)可计算得到氢气和乙醇的物质的量和体积。
$$ {{n}}_{\mathrm{H}}={{X}}_{\mathrm{H}}\left({{n}}_{\mathrm{H}}+{{n}}_{\mathrm{E}}\right)={{X}}_{\mathrm{H}}\frac{0.21{\varphi }}{0.21{\varphi}+0.5{{X}}_{\mathrm{H}}+3{{X}}_{\mathrm{E}}}\frac{{{P}}_{0}{{V}}_{0}}{{R}{T}_{0}} $$ (2) $$ {{n}}_{\mathrm{E}}={{X}}_{\mathrm{E}}\left({{n}}_{\mathrm{H}}+{{n}}_{\mathrm{E}}\right)={{X}}_{\mathrm{E}}\frac{0.21{\varphi }}{0.21{\varphi }+0.5{{X}}_{\mathrm{H}}+3{{X}}_{\mathrm{E}}}\frac{{{P}}_{0}{{V}}_{0}}{{R}{T}_{0}} $$ (3) $$ {{V}}_{\mathrm{H}}=\frac{{{n}}_{\mathrm{H}}{M}_{\mathrm{H}}}{{{\rho }}_{\mathrm{H}}} $$ (4) $$ {{V}}_{\mathrm{E}}=\frac{{{n}}_{\mathrm{E}}{{M}}_{\mathrm{E}}}{{{\rho }}_{\mathrm{E}}} $$ (5) 式中:
nH ——氢气物质的量(mol);
nE ——乙醇物质的量(mol);
XH ——氢气的比例(%);
XE ——乙醇的比例(%);
MH ——氢气的摩尔质量(g/mol);
ME ——乙醇的摩尔质量(g/mol);
ρH ——氢气的密度(g/cm³);
ρE ——乙醇的密度(g/cm³);
VH ——氢气的体积(cm³);
VE ——乙醇的体积(cm³)。
图2为使用HALCON软件对火焰图像的处理结果,步骤如下:(1)对导入的图像进行预处理,包括去噪、增强对比度等,以便更好地提取火焰前锋面;(2)利用HALCON中的边缘检测算子检测火焰前锋面的边缘;(3)对检测到的边缘进行形态学处理以去除噪声并平滑边界;(4)提取火焰前锋面轮廓;(5)通过拟合圆形的方法,拟合火焰前锋面的轮廓,从而得到火焰前锋的半径;(6)根据拟合得到的圆形,测量其直径或半径,即为火焰前锋的半径。
在球形扩散火焰中,拉伸火焰传播速度Sb可以由公式(6)[20]得:
$$ \mathrm{\mathit{S}_{\text{b}}}=\frac{\mathrm{d}r_{\mathrm{u}}}{\mathrm{d}t} $$ (6) 式中:
ru ——实际火焰半径(mm);
t ——时间(s);
Sb ——拉伸火焰传播速度(mm/s)。
对于球形膨胀火焰来说,火焰拉伸率α可由公式(7)得:
$$ \alpha =\frac{1}{{A}}\frac{{A}}{\mathrm{d}{t}}=\frac{2}{{{r}}_{\mathrm{u}}}{{S}}_{\mathrm{b}} $$ (7) 根据非线性拟合后得出的无拉伸火焰传播速度[21],如公式(8)所示:
$$ {\left(\frac{{S}_{\mathrm{b}}}{{S}_{\mathrm{b}}^{0}}\right)}^{2}\mathrm{l}\mathrm{n}{\left(\frac{{S}_{\mathrm{b}}}{{S}_{\mathrm{b}}^{0}}\right)}^{2}=\frac{-2{L}_{\mathrm{b}}\mathrm{\alpha }}{{S}_{\mathrm{u}}^{0}} $$ (8) 预混燃气的层流燃烧速度由公式(9)得:
$$ {{u}}_{\mathrm{L}}={{S}}_{\mathrm{b}}^{0}\frac{{\mathrm{\rho }}_{\mathrm{b}}}{{\mathrm{\rho }}_{\mathrm{u}}} $$ (9) 式中:
uL ——层流燃烧速度(mm/s);
$ \rho_{\mathrm{b}} $和$ \rho_{\mathrm{u}} $ ——已燃气与未燃气的密度(mol);
$ {S}_{\mathrm{b}}^{0} $ ——无拉伸火焰传播速度(mm/s)。
-
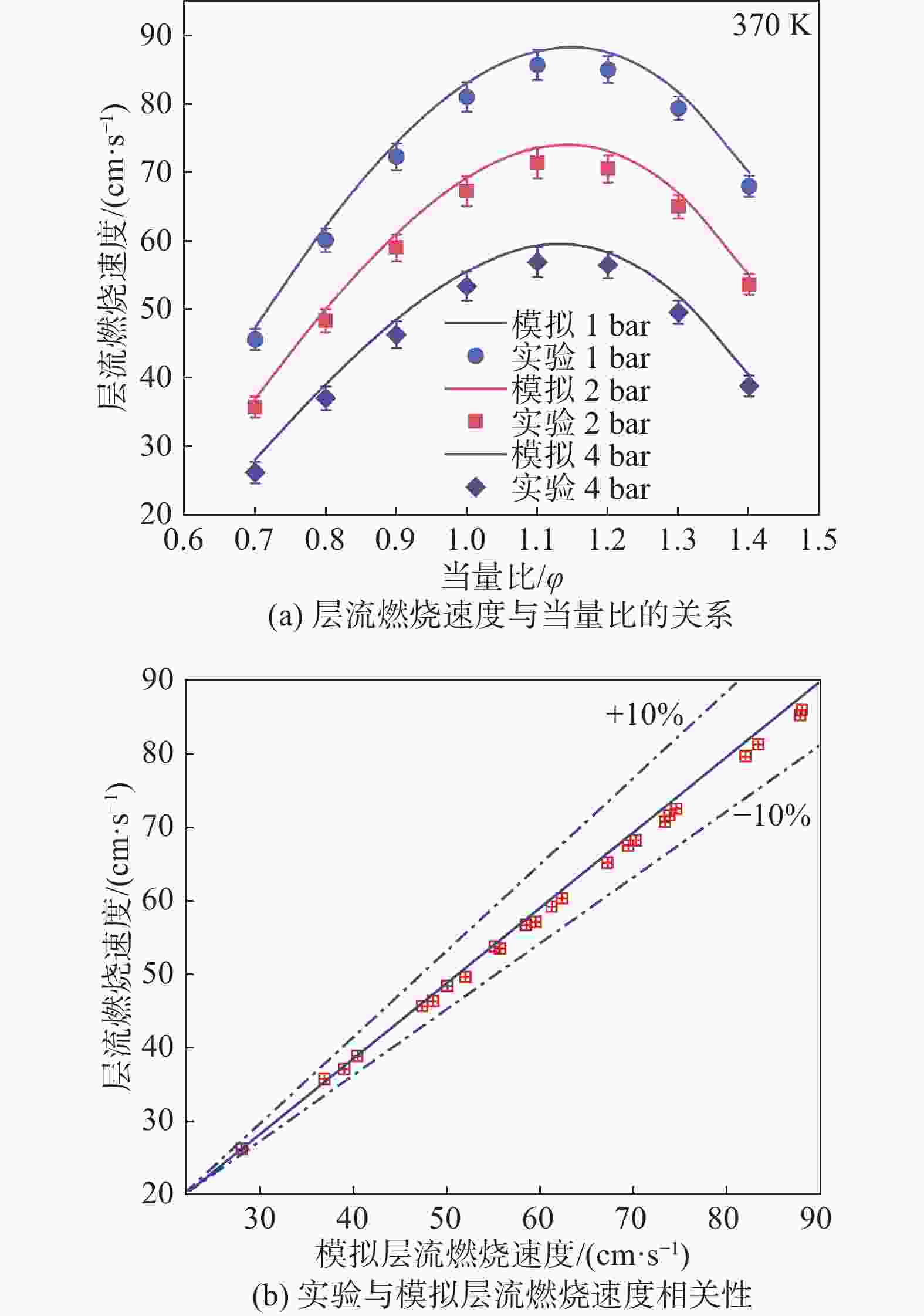
在本研究中,为了获得乙醇与氢气混合物的层流火焰速度、火焰结构和自由基分布,需要对化学反应机理进行选择,Marinov[22]的乙醇氧化反应机理以其高精度、详细的反应网络和广泛的适用性在燃烧模拟领域具有显著优势。与其他机理相比,Glarborg机理的模拟精度较低,LLNL机理主要针对特定燃料,需要进行大量调整或修正,实用性较低,POLIMI机理计算复杂时间成本高,对于实时模拟或快速预测不够高效,而Marinov机理在乙醇燃烧的描述上更为详细且高效,因此最终选择Marinov的乙醇氧化反应机理。此外,文章采用非拉伸、绝热、自由传播的平面火焰,采用Chemkin编码求解稳态质量、物质、能量守恒方程。模拟过程中还考虑了Soret效应[23]。最后,仿真过程中迭代过程的相对误差和绝对误差均小于10−6,完全满足仿真过程的计算要求。将上述实验装置得到的层流火焰速度与文献[24-26]中提取的相应数据进行对比,得到乙醇氢气混合物的模型值与结果如图3所示。由于燃料和氧化剂的物理性质在仿真中可用了理论值,而这些值与实际情况存在误差,实验测量本身也会有误差,包括操作误差以及环境因素,这些误差会导致实验测量值偏低。从图中可以看出,本研究测量的层流火焰速度与文献中提取的大部分数据点趋势相同,非常吻合,表明本研究使用的实验设备的准确性得到了验证。
-
图4展示了火焰传播纹影图像。从图4(a)可以看出,当初始压力为2 bar时,随着当量比的增加,火焰传播速度先增大后减小。这是因为在贫燃阶段,随着当量比的增加,燃烧释放更多的能量,而当当量比较高时,混合物中的氧气浓度减小,使得火焰区域内部的燃烧速率降低。从图4(b)可以发现,在当量比为1.0时,压力的增大会抑制火焰传播速度。这是因为增加压力会使气体更加密集,减缓了氧气和燃料之间的相互扩散和混合速度,从而限制了燃烧反应的进行和火焰的传播速度。
-
图5是不同压力下乙醇氢气混合物的层流燃烧速度图。符号表示实验值,线条表示仿真模拟值。如图5(a)所示,各压力下的层流燃烧速度均随当量比的增大先增大后减小,在φ ≈ 1.1时达到峰值。这是因为当量比的增大会增加燃料和氧化剂的接触面积和反应区域,从而提高燃料在单位时间内的燃烧速度。随着压力的增大,层流燃烧速度减小,这是因为层流燃烧中,燃料与氧气需要彼此扩散以实现有效的混合。当压力增加时,燃料和氧气之间的质量传输过程受到限制。较高的压力会增加燃料和氧气之间的扩散距离,导致更长的混合时间和较慢的燃烧速度。如图5(b)所示,拟合的层流燃烧速度和实验的层流燃烧速度在±10%范围内的相关性良好,证明了由Marinov[22]的乙醇氧化反应机理可以合理预测不同乙醇氢气混合物层流燃烧速度的变化,且在所有工况下的实验值与仿真模拟值吻合较好,进一步证实了化学机理的准确性和可靠性。
-
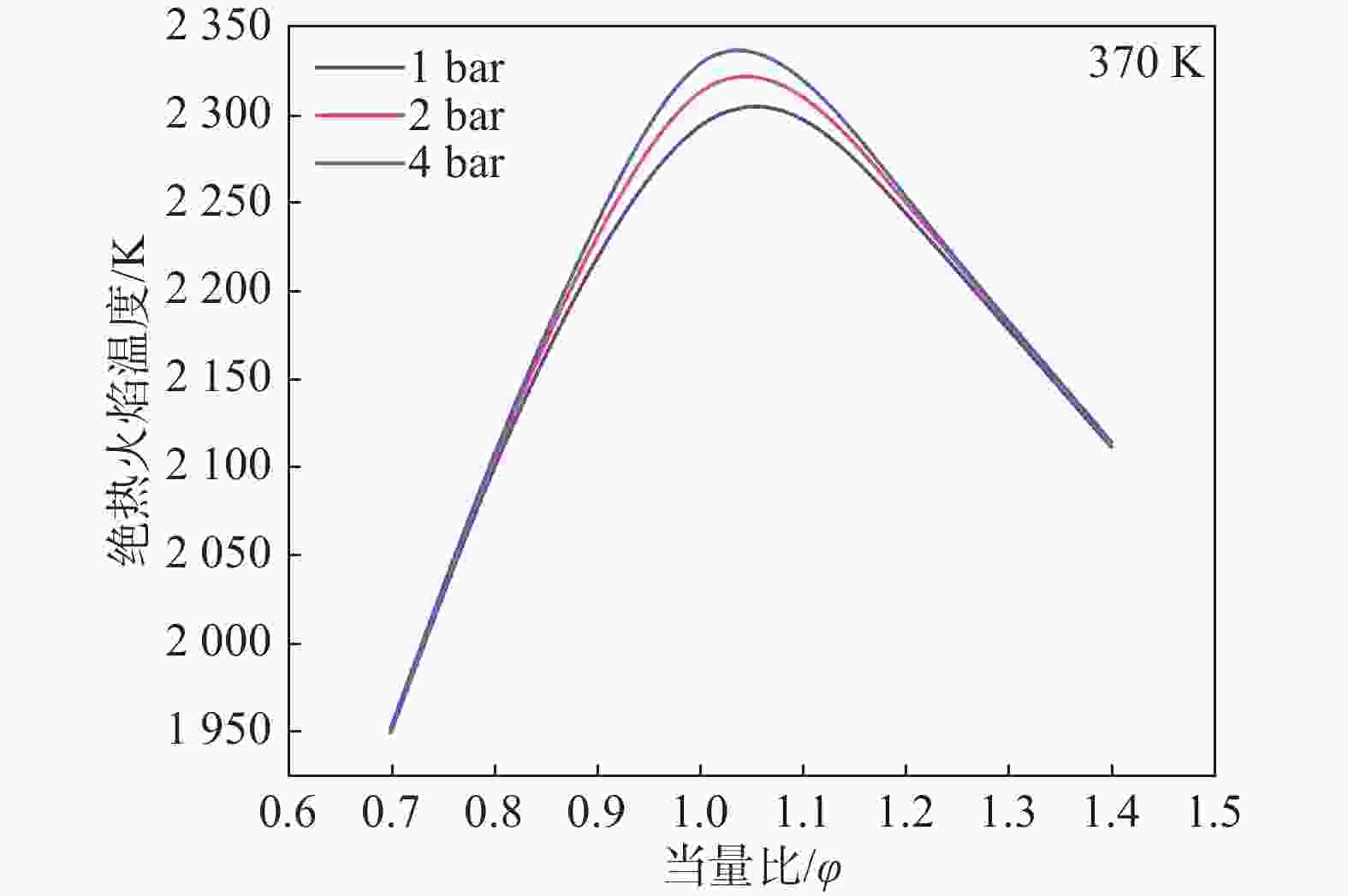
为了对影响预混燃气层流燃烧速度的因素进行详细分析,因此对影响燃气化学反应速率的绝热火焰温度变化受压力和当量比的变化规律进行探究。绝热火焰温度(Adiabatic Flame Temperature,AFT)是反应燃烧达到最高平衡温度的关键参数,图6给出了不同压力下的AFT。AFT随当量比的增大先增大后减小,在φ=1.0~1.1达到最大值。在富燃阶段绝热火焰温度之所以会降低,是因为没有足够的空气来促进燃料完全燃烧,导致热量释放减少[27]。随着压力的增大,混合燃料的AFT逐渐增大。在贫燃阶段压力的变化对AFT的影响非常小,但随着当量比的增加,压力对AFT的影响逐渐增加,在AFT达到峰值时压力对其的影响最明显。这是因为在化学计量比附近时,燃料和氧化剂完全反应,释放出最大量的热量,在这种情况下,压力的变化会显著地影响反应速率和热量释放,从而更明显地影响绝热火焰温度。由于AFT是与燃料的层流燃烧速度呈正相关的重要参数[28],因此在层流燃烧速度的变化中也可以观察到这一现象。
-
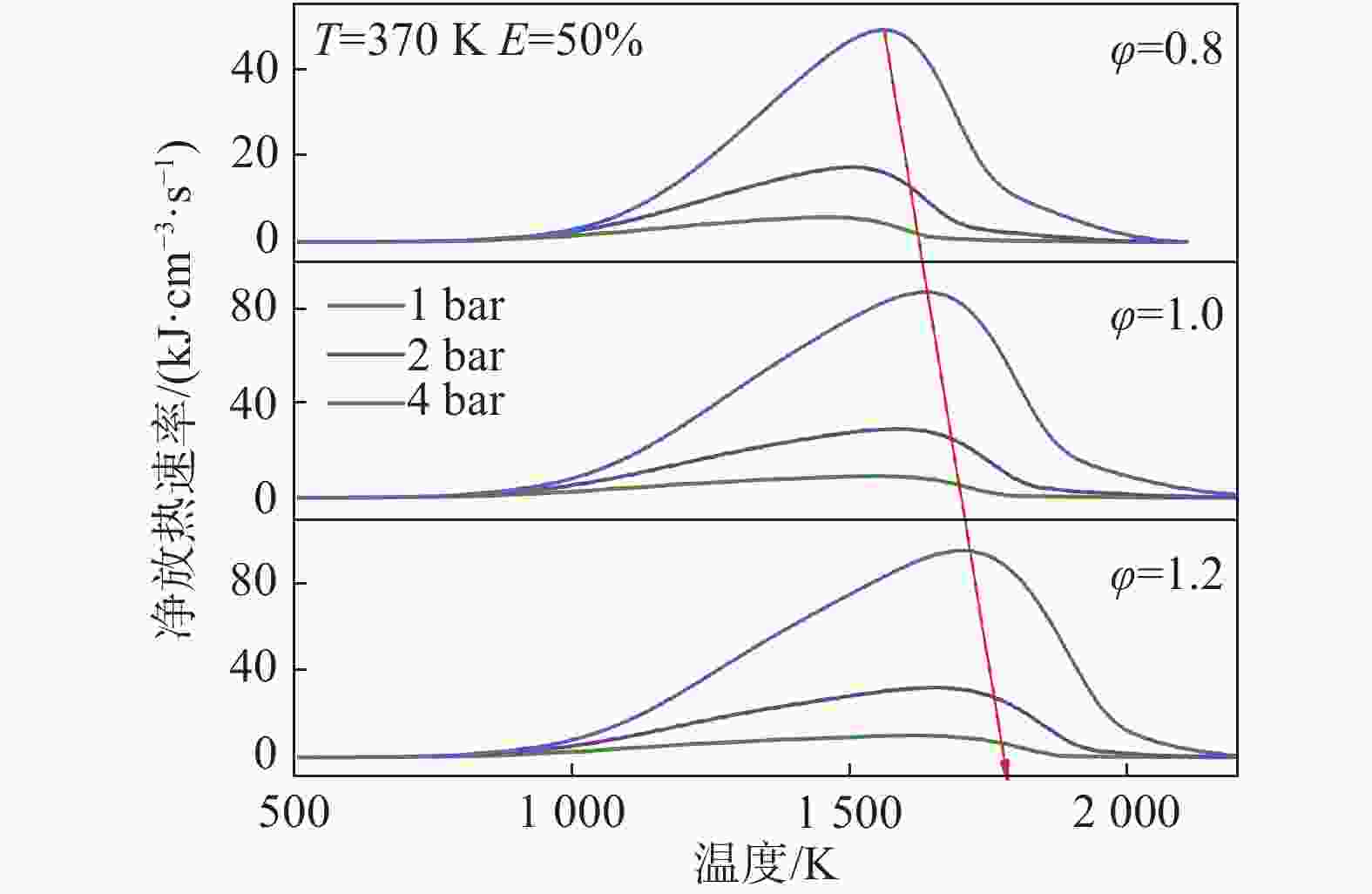
图7清晰地展示了不同当量比和压力下的净放热速率(NHRR),以φ=0.8为例,随着压力的增大,净放热速率不断增大,且向上游移动,说明随着压力的增大,混合燃料低温混合料氧化反应位置发生得更早,这促进了初始燃烧反应。从峰值来看,压力对净放热率的影响是非常明显的。压力的增大可以促进分子之间的碰撞频率,提高了反应物之间克服活化能的可能性,从而增加了反应发生的概率,使得更多的反应物参与反应,进而增大了净放热速率。此外,压力的增加会增加放热密度。根据图示,随着当量比的增加,净放热速率也随之增加,且当量比不影响压力对净放热速率的影响。随着当量比的升高,净放热速率的峰值出现在更高温度的区域。
-
图8(a)和图8(b)分别描述了C2H5OH在初始压力为1 bar、4 bar和当量比为0.7、1.4时的反应路径。为凸显C2H5OH火焰中主要的反应通道和简化反应路径,图中只画出了百分数大于1%的反应路径。箭头旁的“%”表示物质被特定途径消耗的百分比。自由基旁边的“%”表示通过相应的基本反应转化的百分比。C2H5OH的主要反应路径为C2H5OH、SC2H4OH、CH3CHO、CH3CO、CO、CO2,该路径约占C2H5OH消耗的70%;C2H5OH的次级分解路径为C2H5OH、PC2H4OH、C2H3OH,该路径约占C2H5OH消耗的25%。同时,随着压力从1 bar升高到4 bar,主要路径占比由70.9%下降至69.5%,次级路径占比由24.5%上升至25.1%。随着当量比从0.7到1.4,主要路径占比由70.9%上升至71.3%,次级路径占比由24.3%下降至22.0%。

图 8 不同压力和当量比下乙醇的反应路径图
Figure 8. Reaction path diagram of ethanol under different pressures and equivalent ratios
如图8(a)所示,在乙醇反应的不同部位,H基都是乙醇消耗的主要途径。乙醇的吸氧反应主要受到具有不成对电子的活性自由基(H、O、OH、CH3和HO2)的攻击。此外,H、O、和OH自由基在乙醇提取H形成SC2H4OH、PC2H4OH的反应中起主导作用,说明活性自由基池对乙醇的反应有较大影响。接下来,SC2H4OH进一步发生β-裂解反应,生成CH3CHO和CH3CO而PC2H4OH进行H抽提反应生成C2H3OH或C2H4,其中OH起主导作用。CH2自由基是乙醛的主要产物,与O2进一步反应生成HCO和OH,促进链的增值。压力的增大会抑制H基的转化,同时会促进OH和HO2基的转化;当量比的增大会促进H基的转化,同时会抑制OH和HO2基的转化。
-
为了进一步了解活性自由基和中间产物对层流燃烧速度的影响,对乙醇氢气层流燃烧的敏感性进行了分析。图9为不同当量比和压力下的化学反应示意图。如图9所示,R1、R12、R30、R145等反应对乙醇氢气的燃烧有积极影响,加速了反应活性。在这些促进反应性的反应中,R1极大地加速了反应,提高了层流燃烧速度,因为H自由基转化为OH自由基,OH自由基是H燃料链式反应中的重要反应物,能参与大部分的元素反应,加速火焰的传播。相反,R8、R9、R15、R32、R127等反应对燃料的燃烧有不利影响。它们将活性H原子转化为相对稳定的HO2自由基,对整体反应活性有较强的抑制作用,从而降低了层流燃烧速度[29]。其中,三体链终止反应R9和R127明显阻碍了乙醇氢气的反应活性,同时,R127是与甲基(CH3)相关的反应,它消耗活性自由基,形成稳定的产物,也抑制了层流燃烧速度。综上所述,活性自由基(H、O和OH)和其他小自由基(如CH3、HCO和HO2)是影响乙醇氢气层流燃烧速度的主要自由基。
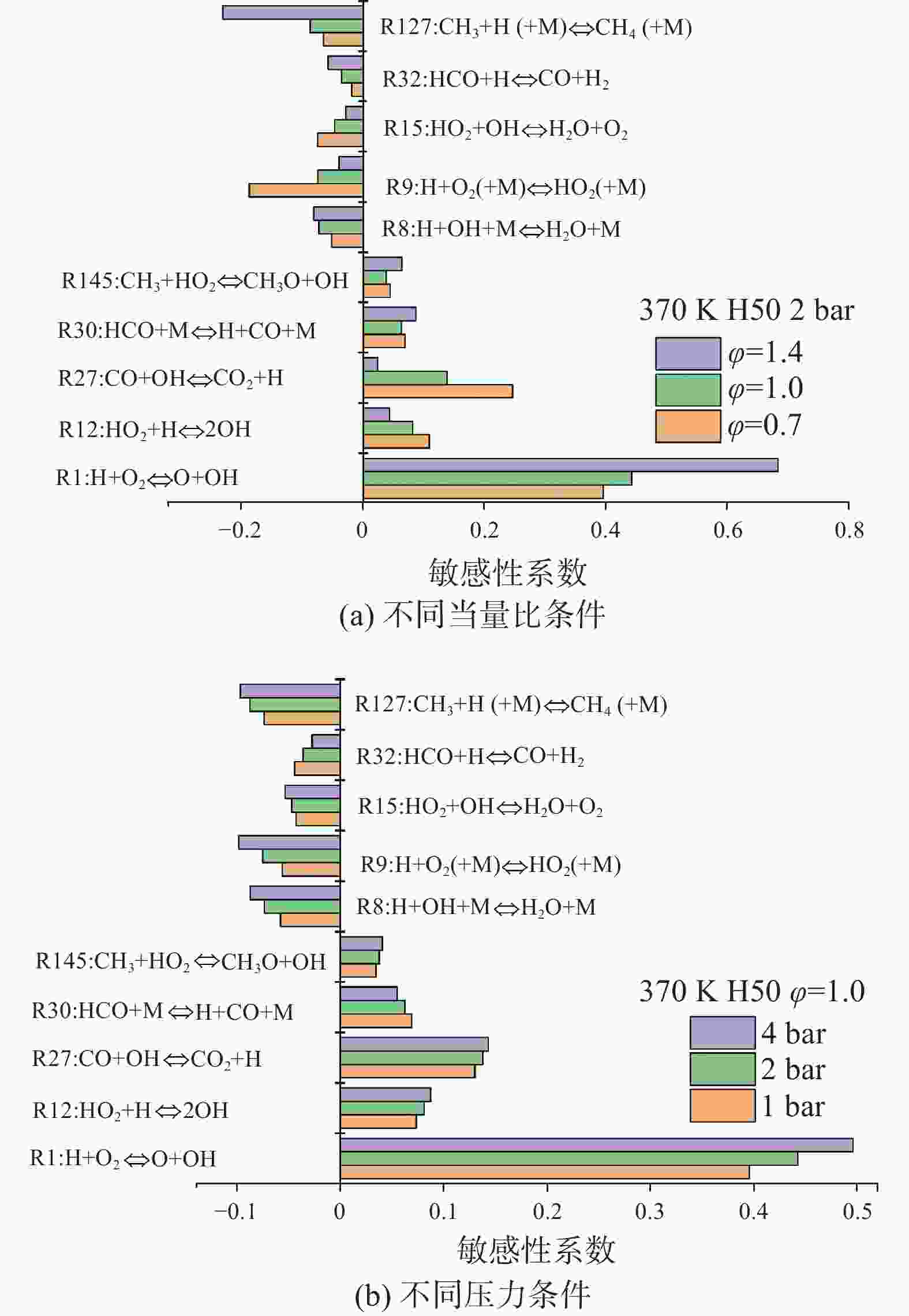
图 9 不同当量比和压力下乙醇氢气层流燃烧速度敏感性系数
Figure 9. Sensitivity coefficients of ethanol-hydrogen laminar combustion velocity under different equivalent ratios and pressures
随着当量比从贫到富的增加,敏感系数的表现也不同,对于促进燃烧反应的R1和R27来说,随着当量比的增加,R1对燃烧的促进作用越来越大,而R27的影响越来越小;说明反应R1对层流燃烧速度的影响越大,混合物越丰富。对于抑制燃烧反应的R9和R127来说,随着当量比的增加,R9对燃烧的抑制作用越来越小,而R127的影响越来越大。R9在贫混合气中具有最大的负敏感系数,而R127在富混合气中具有最大的负敏感系数,以抑制层流燃烧速度。压力的变化对于乙醇氢气燃烧的敏感性变化影响不大,随着压力的增大,R1对层流燃烧速度的促进作用越来越大且变化最明显,R9和R127对层流燃烧速度的抑制作用变化最明显,R9的抑制作用越来越差而R127的抑制作用越来越强。
-
活性自由基具有不成对的电子,因此活性高,能显著提高层流燃烧速度[30]。根据前文所述的反应路径分析以及敏感性分析可知,活性自由基H、OH、O是影响乙醇氢气层流燃烧速度的主要自由基。在乙醇氢气层流燃烧过程中,H的分离是乙醇氧化过程中至关重要的一部分,氢燃烧过程中会产生大量的H自由基,因此有必要了解燃烧过程中的H摩尔分数。图10为不同当量比和初始压力下H的摩尔分数变化曲线。可以看出,随着当量比的增大,从贫燃烧到富燃烧的H峰值逐渐减小且向上游移动。这是因为当量比的增大会导致氧化剂相对于燃料的增加,从而促进燃烧反应的进行。在高当量比条件下,氧气浓度足够使得燃料完全燃烧,这会加快燃烧速率。随着燃烧速率的加快,H自由基的生成速率可能无法与其消耗速率相匹配,导致H自由基摩尔分数逐渐减小;随着初始压力的增大,H的峰值减小并向上游移动。在高压条件下,燃料和氧化剂之间的扩散速率减小,导致燃烧速率降低。这导致燃烧过程中H自由基的生成速率减小,从而使其摩尔分数的峰值减小。
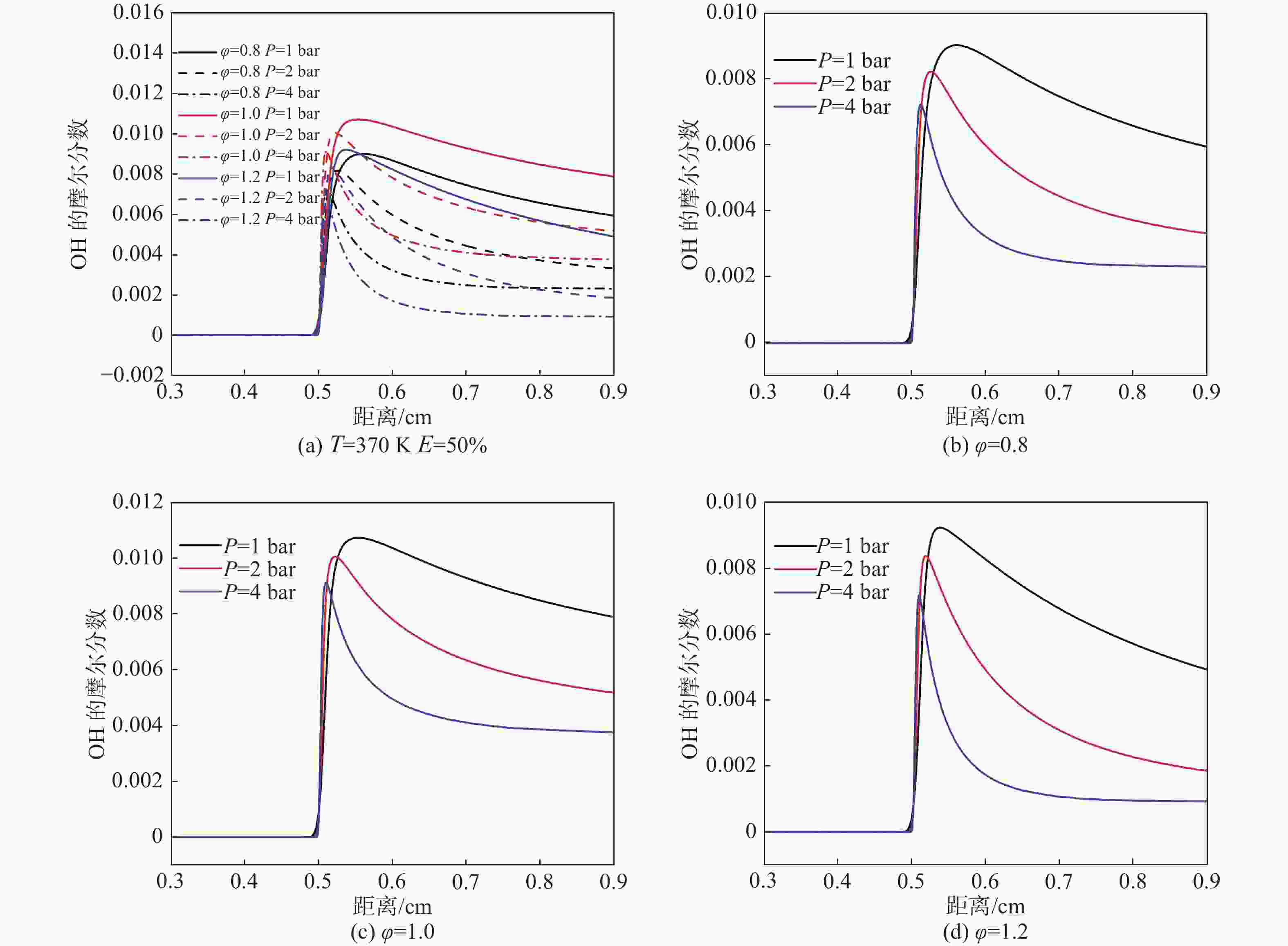
OH自由基具有很强的氧化性。从图11中可以看出,随着压力的增加,OH生成的位置向下游移动,且峰值变小,可以明显看出压力的增加可以增加OH的生成。随着当量比的增大,OH的产额先增加后减少,产额位置由上游向下游变化。
O自由基是重要的中间产物,在燃烧过程中,乙醇和氢气会竞争氧气。通过研究O自由基的位置,我们可以了解乙醇与氢气混合的燃烧过程。如图12所示,随着当量比和压力的增大,O自由基的摩尔分数逐渐下移,峰值摩尔分数逐渐降低并向上游移动。
-
文章在定容燃烧弹内研究了当量比和压力对乙醇氢气预混火焰层流燃烧特性的影响,计算得到了层流燃烧速度和绝热火焰温度并分析了其影响因素,测定了乙醇氢气混合燃料的净放热速率、反应路径及敏感性并对其活性自由基峰值摩尔分数进行了数值研究。研究结果如下:
1)层流燃烧速度与绝热火焰温度在实验当量比范围内均呈先增大后减小的趋势,具有正相关性,均为在化学计量比附近达到最大值。压力对绝热火焰温度的影响在φ=0.9~1.2较为显著,在贫燃区和富燃区的影响相对较弱。
2)压力对净放热速率的影响非常明显,净放热速率的峰值随压力升高而增大,随着压力的增大,净放热速率不断增大,且向上游移动。随着当量比的增加,净放热速率也随之增加,且净放热速率的峰值出现在更高温度区域,表明在较高的温度范围内,反应释放热较大。
3)R1:H+O2⇔O+OH使燃料的反应活性提高,是提高层流燃烧速度最有效的反应,而R9:H+O2(+M)⇔HO2(+M)和R127:CH3+H(+M)⇔CH4(+M)明显阻碍了乙醇氢气的反应活性,同时,R127是与甲基(CH3)相关的反应,它消耗活性自由基,形成稳定的产物,抑制了层流燃烧速度。
4)对影响乙醇氢气层流燃烧速度的主要自由基H、OH、O的摩尔分数进行了分析,随着压力的增大,3种自由基的峰值摩尔分数均逐渐减小且向上游移动,随着当量比的增大H、O自由基摩尔分数逐渐下移,OH自由基摩尔分数先增加后减少。
Laminar Combustion Characteristics of Ethanol-Hydrogen Premixed Fuel
-
摘要:
目的 随着化石燃料的日渐枯竭,生物燃料逐渐进入大众视野,乙醇氢气混合燃料作为新一代可再生清洁燃料引起了广泛关注,开展乙醇氢气预混火焰燃烧特性的影响研究非常有必要。 方法 文章基于定容燃烧系统,结合高速纹影技术,在初始温度为370 K,氢气比例为50%,当量比为0.7~1.4,初始压力为1 bar、2 bar、4 bar条件下研究了当量比和压力对乙醇氢气预混火焰的层流燃烧特性的影响。聚焦火焰的传播燃烧特性,计算得到了层流燃烧速度并分析了其影响因素,借助Chemkin仿真平台建立相关反应模型,采用Marinov的乙醇氧化反应机理,对其层流燃烧特性进行详细的化学动力学分析。 结果 研究表明,层流燃烧速度与绝热火焰温度具有正相关性且均在φ=1.1达到最大值;压力对净放热速率影响显著,当量比越大其峰值出现在更高温度区域;R1:H+O2⇔O+OH是促进火焰层流燃烧速度最敏感的反应。随着压力的增大,H、OH、O自由基的峰值摩尔分数均逐渐减小且向上游移动,随着当量比的增大H、O自由基摩尔分数逐渐下移,OH自由基摩尔分数先增加后减少。 结论 当量比、压力以及活性自由基对乙醇氢气预混层流燃烧特性的影响显著,可为后续研究提供理论依据。 Abstract:Objective With the depletion of fossil fuels and bio-fuels' emergence, ethanol-hydrogen hybrid fuel as a new generation of renewable clean fuel has attracted wide attention, so it is necessary to study the effect of ethanol-hydrogen premixed flame combustion characteristics. Method Based on the constant volume combustion system and combined with high-speed schlieren technology, the effects of the equivalent ratio and pressure on the laminar combustion characteristics of ethanol-hydrogen premixed flame were studied under the conditions of initial temperature of 370 K, hydrogen ratio of 50%, equivalent ratio of 0.7~1.4 and initial pressure of 1, 2 and 4 bar. Focusing on the propagation combustion characteristics of the flame, the laminar combustion velocity was calculated and its influencing factors were analyzed. The relevant reaction model was established with the help of Chemkin simulation platform, and the chemical dynamics of the laminar combustion characteristics were analyzed in detail by using Marinov's ethanol oxidation reaction mechanism. Result The results showed that the laminar combustion velocity was positively correlated with the adiabatic flame temperature and reached the maximum value around φ=1.1. The pressure significantly affects the net heat release rate, and the peak value occurs in the higher temperature region with a greater equivalent ratio. R1:H+O2⇔O+OH represents the most sensitive reaction which promotes the laminar combustion velocity of the flame. With the increase of pressure, the peak molar fraction of H, OH, and O free radicals gradually decreased and moved upstream. With the increase of the equivalent ratio, the molar fraction of H and O free radicals gradually decreased, and the molar fraction of OH free radicals first increased and then decreased. Conclusion The equivalent ratio, pressure and active free radicals have significant effects on the laminar combustion characteristics of ethanol-hydrogen premixed fuel, which can provide theoretical basis for subsequent studies. -
-
[1] SIKIRU S, OLADOSU T L, AMOSA T I, et al. Hydrogen-powered horizons: transformative technologies in clean energy generation, distribution, and storage for sustainable innovation [J]. International journal of hydrogen energy, 2024, 56: 1152-1182. DOI: 10.1016/j.ijhydene.2023.12.186. [2] 李小龙, 洪小飞, 陈宇卿. 燃气轮机掺氢燃烧技术 [J]. 南方能源建设, 2023, 10(6): 14-25. DOI: 10.16516/j.gedi.issn2095-8676.2023.06.002. LI X L, HONG X F, CHEN Y Q. Hydrogen-blended combustion technology in gas turbine [J]. Southern energy construction, 2023, 10(6): 14-25. DOI: 10.16516/j.gedi.issn2095-8676.2023.06.002. [3] MENDIBURU A Z, LAUERMANN C H, HAYASHI T C, et al. Ethanol as a renewable biofuel: combustion characteristics and application in engines [J]. Energy, 2022, 257: 124688. DOI: 10.1016/j.energy.2022.124688. [4] 刘鑫, 田静, 赵梅, 等. 清洁燃料车用乙醇汽油现状及展望 [J]. 云南化工, 2018, 45(7): 1-2. DOI: 10.3969/j.issn.1004-275X.2018.07.001. LIU X, TIAN J, ZHAO M, et al. Current status and prospects of clean fuel vehicle ethanol gasoline [J]. Yunnan chemical technology, 2018, 45(7): 1-2. DOI: 10.3969/j.issn.1004-275X.2018.07.001. [5] AYAD S M M E, BELCHIOR C R P, SODRÉ J R. Hydrogen addition to ethanol-fuelled engine in lean operation to improve fuel conversion efficiency and emissions [J]. International journal of hydrogen energy, 2024, 49: 744-752. DOI: 10.1016/j.ijhydene.2023.09.048. [6] 王子兴, 杨美娥, 王浩鹏, 等. 基于多孔介质燃烧器的氨重整制氢技术分析 [J]. 南方能源建设, 2023, 10(3): 55-62. DOI: 10.16516/j.gedi.issn2095-8676.2023.03.006. WANG Z X, YANG M E, WANG H P, et al. Technical analysis of ammonia reforming hydrogen production based on porous medium burner [J]. Southern energy construction, 2023, 10(3): 55-62. DOI: 10.16516/j.gedi.issn2095-8676.2023.03.006. [7] 张杰, 罗雪鹏. 液氢制-储-运-加关键技术发展现状及展望 [J]. 发电技术, 2024, 45(5): 888-898. DOI: 10.12096/j.2096-4528.pgt.24019. ZHANG J, LUO X P. Development status and prospect of key technologies for liquid hydrogen production-storage-transportation-refueling [J]. Power generation technology, 2024, 45(5): 888-898. DOI: 10.12096/j.2096-4528.pgt.24019. [8] 赵钦新, 王宗一, 邓世丰, 等. 氢气燃烧技术及其进展 [J]. 科学技术与工程, 2022, 22(36): 15870-15880. DOI: 10.3969/j.issn.1671-1815.2022.36.003. ZHAO Q X, WANG Z Y, DENG S F, et al. Hydrogen combustion technology and progress [J]. Science technology and engineering, 2022, 22(36): 15870-15880. DOI: 10.3969/j.issn.1671-1815.2022.36.003. [9] VASANTHAKUMAR R, LOGANATHAN M, CHOCKALINGAM S, et al. A study on the effect of hydrogen enriched intake air on the characteristics of a diesel engine fueled with ethanol blended diesel [J]. International journal of hydrogen energy, 2023, 48(53): 20507-20524. DOI: 10.1016/j.ijhydene.2023.02.113. [10] AYAD S M M E, BELCHIOR C R P, SODRÉ J R. Exergoeconomic analysis of a lean burn engine operating with ethanol and hydrogen addition [J]. International journal of hydrogen energy, 2024, 61: 387-394. DOI: 10.1016/j.ijhydene.2024.02.279. [11] 刘畅, 林汉辰, 史陈芳达, 等. 中国氢燃料电池汽车市场发展现状及展望 [J]. 南方能源建设, 2024, 11(2): 162-171. DOI: 10.16516/j.ceec.2024.2.16. LIU C, LIN H C, SHI C F D, et al. Development status and outlook of hydrogen powered fuel cell vehicle market in China [J]. Southern energy construction, 2024, 11(2): 162-171. DOI: 10.16516/j.ceec.2024.2.16. [12] WANG Y F, VERHELST S. Comparative analysis and optimisation of hydrogen combustion mechanism for laminar burning velocity calculation in combustion engine modelling [J]. International journal of hydrogen energy, 2024, 56: 880-893. DOI: 10.1016/j.ijhydene.2023.12.214. [13] XU C S, WANG Q Y, LI X L, et al. Effect of hydrogen addition on the laminar burning velocity of n-decane/air mixtures: experimental and numerical study [J]. International journal of hydrogen energy, 2022, 47(44): 19263-19274. DOI: 10.1016/j.ijhydene.2022.03.290. [14] XIAO H H, LI H Z. Experimental and kinetic modeling study of the laminar burning velocity of NH3/DME/AIR premixed flames [J]. Combustion and flame, 2022, 245: 112372. DOI: 10.1016/j.combustflame.2022.112372. [15] CHEN J N, YANG X M. Numerical study of hydrogen blending on the laminar combustion characteristics of n-decane/air mixtures [J]. Chemical engineering science, 2023, 277: 118872. DOI: 10.1016/j.ces.2023.118872. [16] OPPONG F, LUO Z Y, LI X L, et al. Laminar combustion characteristics of ethyl acetate/hydrogen/air at elevated pressures [J]. Fuel, 2022, 330: 125631. DOI: 10.1016/j.fuel.2022.125631. [17] 徐一博, 暴秀超, 左子农, 等. 掺氢对汽油预混燃烧特性的影响 [J]. 内燃机工程, 2022, 43(2): 12-19. DOI: 10.13949/j.cnki.nrjgc.2022.02.002. XU Y B, BAO X C, ZUO Z N, et al. Effects of hydrogen addition on premixed combustion characteristics of gasoline [J]. Chinese internal combustion engine engineering, 2022, 43(2): 12-19. DOI: 10.13949/j.cnki.nrjgc.2022.02.002. [18] WANG X R, ZHANG Y, LI T, et al. Investigation of cellularization characteristics of hydrogen-methane-ethanol expanding spherical flame at elevated pressures [J]. Combustion and flame, 2023, 255: 112866. DOI: 10.1016/j.combustflame.2023.112866. [19] 闫晨朝, 姜根柱, 王筱蓉. 氢气-乙醇-空气预混层流燃烧特性仿真研究 [J]. 新能源进展, 2023, 11(5): 450-456. DOI: 10.3969/j.issn.2095-560X.2023.05.009. YAN C Z, JIANG G Z, WANG X R. Simulation study on laminar combustion characteristics of hydrogen-ethanol-air premix [J]. Advances in new and renewable energy, 2023, 11(5): 450-456. DOI: 10.3969/j.issn.2095-560X.2023.05.009. [20] SUN Z Y. Experimental studies on the explosion indices in turbulent stoichiometric H2/CH4/air mixtures [J]. International journal of hydrogen energy, 2019, 44(1): 469-476. DOI: 10.1016/j.ijhydene.2018.02.094. [21] XIAO P, LEE C F, WU H, et al. Effects of hydrogen addition on the laminar methanol-air flame under different initial temperatures [J]. Renewable energy, 2020, 154: 209-222. DOI: 10.1016/j.renene.2020.03.037. [22] MARINOV N M. A detailed chemical kinetic model for high temperature ethanol oxidation [J]. International journal of chemical kinetics, 1999, 31(3): 183-220. DOI: 10.1002/(SICI)1097-4601(1999)31:3<183::AID-KIN3>3.0.CO;2-X. [23] D’ALESSIO F, MATTEUCCI C, LAPENNA P E, et al. Intrinsic instability of lean hydrogen/ammonia premixed flames: influence of soret effect and pressure [J]. Fuel communications, 2024, 19: 100110. DOI: 10.1016/j.jfueco.2024.100110. [24] HINTON N, STONE R, CRACKNELL R, et al. Aqueous ethanol laminar burning velocity measurements using constant volume bomb methods [J]. Fuel, 2018, 214: 127-134. DOI: 10.1016/j.fuel.2017.10.113. [25] SHANKAR V, FANG X H, HINTON N, et al. Effect of ethanol addition on the laminar burning velocities of gasoline surrogates [J]. Fuel, 2022, 327: 125186. DOI: 10.1016/j.fuel.2022.125186. [26] KATOCH A, MILLÁN-MERINO A, KUMAR S. Measurement of laminar burning velocity of ethanol-air mixtures at elevated temperatures [J]. Fuel, 2018, 231: 37-44. DOI: 10.1016/j.fuel.2018.05.083. [27] ECKART S, BENAISSA S, ALSULAMI R A, et al. Laminar burning velocity, emissions, and flame structure of dimethyl ether-hydrogen air mixtures [J]. International journal of hydrogen energy, 2023, 48(91): 35771-35785. DOI: 10.1016/j.ijhydene.2023.05.261. [28] WANG Z, JI C W, WANG D, et al. Experimental and numerical study on laminar burning velocity and premixed combustion characteristics of NH3/C3H8/air mixtures [J]. Fuel, 2023, 331: 125936. DOI: 10.1016/j.fuel.2022.125936. [29] WANG X R, YAN C Z, ZHANG Y, et al. Laminar and kinetic burning characteristics of ethanol/methane/hydrogen fuel: experimental and numerical analysis [J]. Renewable energy, 2024, 227: 120493. DOI: 10.1016/j.renene.2024.120493. [30] XIE S R, LI X, LI T, et al. Experimental and numerical study on the laminar burning velocities of n-decane/toluene/air mixtures at elevated temperatures [J]. Fuel, 2022, 322: 124176. DOI: 10.1016/j.fuel.2022.124176. -




 下载:
下载: