-
全球能源系统正在往脱碳化方向发展并向净零情景转型[1],各个国家按照《巴黎协定》要求持续深度脱碳以应对气候变化,但自2016年各国签定《巴黎协定》以来,除2020年由于新冠疫情封控和防疫措施的影响碳排放量下降外,其余年份碳排放量持续增加。根据2022年第71版《BP世界能源年鉴》[2],2021年能源产生的CO2排放量比上年增长5.9%,达到338.8亿t;2021年因能源、过程排放、甲烷和放空燃烧产生的CO2当量排放比上年增长5.7%,达到389.8亿tCO2当量,基本接近疫情前的水平。2023年3月国际能源署发布的《2022年CO2排放》[3],2022年全球能源相关CO2排放量超过368亿t,比2021年增加3.21亿t,增长0.9%。中国2022年的能源相关CO2排放量达到114.8亿t,占世界碳排放的31%左右,与2021年相比基本持平,下降了0.2%,即2 300万t。同时,这也是自我国推动降碳减排以来的首次年度CO2排放下降[4]。可见,减少CO2的排放对于我国和世界各国仍是巨大的挑战。
碳捕集、利用和封存(Carbon Capture, Utilization and Storage, CCUS)技术是一种实现快速和深度脱碳所需的低碳能源与技术,其中利用CO2加氢催化合成甲醇[5-7]具有可行性,通过电解水得到的氢气,与捕集的CO2合成甲醇,不仅可实现碳资源的大规模有效利用,还可以将产物甲醇作为氢气的储存载体[8-9]。
甲醇可以作为替代燃料用于交通运输、发电和工业生产等领域,其能量密度高、易于储存和运输[10],可与传统石油燃料混合使用或直接替代燃料,具有较好的适应性,甲醇是一种理想的替代能源,能够大规模高效储能,也是一种重要的化工原料,用于生产甲醛和乙酸等有机化工产品[11-12]。常压下甲醇的沸点和熔点分别是64.8 ℃、−97.8 ℃,便于以液体形式储存、运输及配送,可充分利用现有石油、柴油等液体能源基础设施。2021年,我国的甲醇行业CO2排放量在化工全产业碳排放总量中占比超过17%,达1.96亿t[13],因此甲醇生产的绿色发展已成为必然趋势。
利用新能源电解水生产的绿氢,与全球排放的CO2催化合成甲醇和水,不仅可以实现CO2的减排利用,还可将可再生能源储存于液体燃料,用绿氢将CO2转化为甲醇对于解决CO2排放和能源紧缺问题极具经济价值和工业化应用前景。
目前,国内外有关CO2加氢催化合成甲醇的研究在催化剂[14-16]方面报道最多,主要包括Cu基催化剂、贵金属以及过渡元素催化剂、非贵金属氧化物催化剂3大类。另有一部分研究进行了相关工艺流程模拟,但未深入探究反应合成参数的选取,且更多仅关注甲醇合成过程,未与电解水结合。文章聚焦甲醇合成工艺模拟,考虑氢源来自电解水制氢,详细分析了温度、压力、CO2/H2进料比对甲醇产量的影响,为CO2催化加氢制甲醇工艺、电解水与甲醇合成结合提供了理论依据。
-
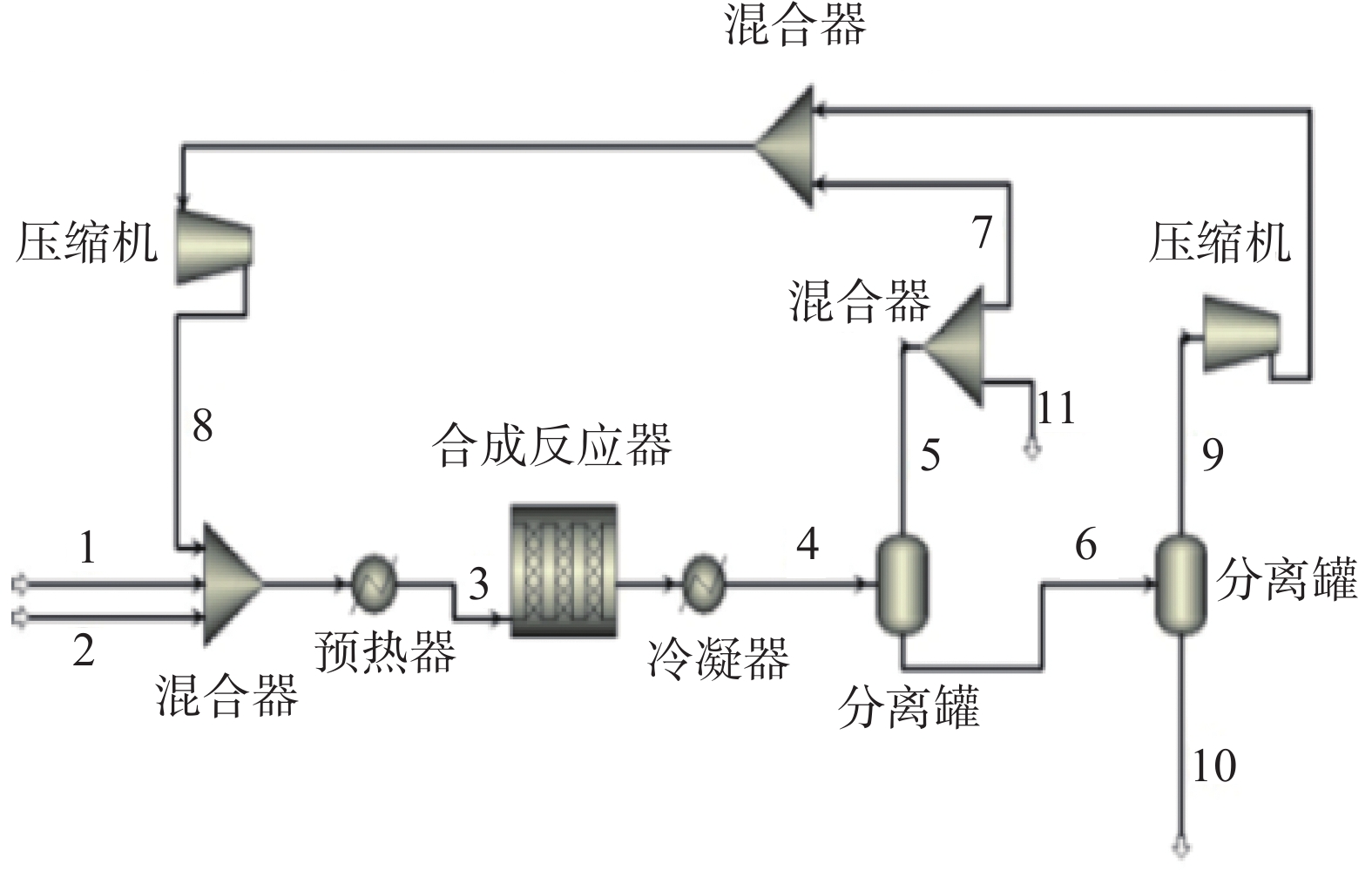
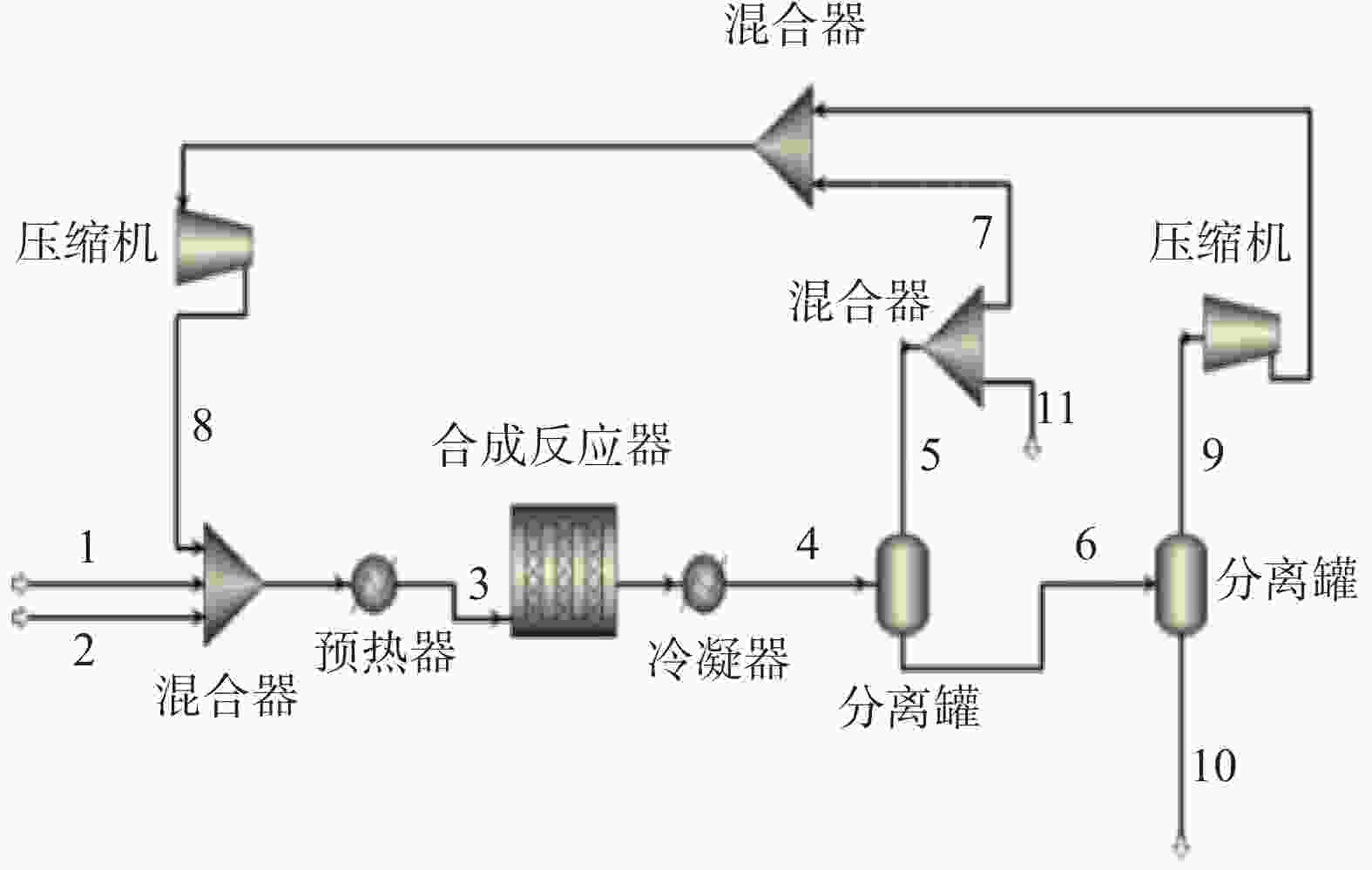
本文利用Aspen Plus模拟软件,基于Kiss[9]和Nyari[11]等人的模型构建了甲醇合成工艺,工艺流程如图1所示。
考虑H2气源直接来自于电解水制氢[17-19]得到的稳定5 MPa H2,简化考虑CO2气源同为5 MPa,两组气源和循环气于混合器内充分混合,然后加热至250 ℃。根据甲醇合成反应方程式的化学计量比,H2气源和CO2气源的进料量分别为7 500 kg/h和54 975 kg/h。
加热后的混合气体进入合成反应器进行甲醇合成反应,主要发生公式(1)~公式(3)的可逆反应[20],也就是H2和CO2可以直接反应生成甲醇,还可以发生逆水煤气变换反应,再由H2和CO2反应生成甲醇。
$$ \mathrm{CO+2H}_{\mathrm{2}}\leftrightharpoons\mathrm{CH}_{\mathrm{3}}\mathrm{OH}\;\Delta\mathit{H}_{\mathrm{298K}}\mathrm{=-90.8\;kJ/mol} $$ (1) $$ \mathrm{CO}_{\mathrm{2}}\mathrm{+H}_{\mathrm{2}}\leftrightharpoons\mathrm{CO+H}_{\mathrm{2}}\mathrm{O}\;\Delta\mathit{H}_{\mathrm{298K}}\mathrm{=+41.2\;kJ/mol} $$ (2) $$ \mathrm{CO}_{\mathrm{2}}\mathrm{+3H}_{\mathrm{2}}\leftrightharpoons\mathrm{CH}_{\mathrm{3}}\mathrm{OH+H}_{\mathrm{2}}\mathrm{O}\;\Delta\mathit{H}_{\mathrm{298K}}\mathrm{=-49.1\;kJ/mol} $$ (3) 以上公式(1)~公式(3)的可逆反应分别遵循速率方程公式(4)~公式(6)。
$$ \begin{split} &{r}_{A}={r}_{\mathrm{C}\mathrm{H}_3\mathrm{O}\cdot \mathrm{C}\mathrm{O}}=\\&{k}_{{A}}\frac{{K}_{\mathrm{C}\mathrm{O}}\left[{f}_{\mathrm{C}\mathrm{O}}\right.{f}_{{\mathrm{H}}_2}^{\tfrac{3}{2}}-{f}_{\mathrm{C}\mathrm{H}_3\mathrm{O}\mathrm{H}}/\left({K}_{A}\right.\sqrt{{f}_{\mathrm{H}_2}}\left.)\right]}{\left(1\right.+{K}_{\mathrm{C}\mathrm{O}}{f}_{\mathrm{C}\mathrm{O}}+{K}_{\mathrm{C}\mathrm{O}_2}{f}_{\mathrm{C}\mathrm{O}_2}\left)\right[\sqrt{{f}_{\mathrm{H}_2}}+\left({{K}_{\mathrm{H}_2\mathrm{O}}/\sqrt{{K}_{\mathrm{H}}})f}_{\mathrm{H}_2{\mathrm{O}}}\right]} \end{split} $$ (4) $$ \begin{split} &{r}_{B}={r}_{\mathrm{C}\mathrm{O}}={r}_{\mathrm{H}_2\mathrm{O}}=\\&{k}_{B}\frac{{K}_{\mathrm{C}\mathrm{O}2}\left[{f}_{\mathrm{C}\mathrm{O}_2}\right.{f}_{\mathrm{H}_2}-{f}_{\mathrm{H}_2\mathrm{O}}{f}_{\mathrm{C}\mathrm{O}}/{K}_{B}]}{\left(1\right.+{K}_{\mathrm{C}\mathrm{O}}{f}_{\mathrm{C}\mathrm{O}}+{K}_{\mathrm{C}\mathrm{O}_2}{f}_{\mathrm{C}\mathrm{O}_2}\left)\right[\sqrt{{f}_{\mathrm{H}_2}}+\left({{K}_{\mathrm{H}_2\mathrm{O}}/\sqrt{{K}_{\mathrm{H}}})f}_{\mathrm{H}_2{\mathrm{O}}}\right]} \end{split} $$ (5) $$ \begin{split} &{r}_{C}={r}_{\mathrm{C}\mathrm{H}_3\mathrm{O}\cdot \mathrm{C}\mathrm{O}_2}=\\&{k}_{C}\frac{{K}_{\mathrm{C}\mathrm{O}_2}\left[{f}_{\mathrm{C}\mathrm{O}_2}\right.{f}_{{\mathrm{H}}_2}^{\tfrac{3}{2}}-{{f}_{\mathrm{H}_2\mathrm{O}}f}_{\mathrm{C}\mathrm{H}_3\mathrm{O}\mathrm{H}}/({f}_{{\mathrm{H}}_2}^{\tfrac{3}{2}}{K}_{C}\left.)\right]}{\left(1\right.+{K}_{\mathrm{C}\mathrm{O}}{f}_{\mathrm{C}\mathrm{O}}+{K}_{\mathrm{C}\mathrm{O}_2}{f}_{\mathrm{C}\mathrm{O}_2}\left)\right[\sqrt{{f}_{\mathrm{H}_2}}+\left({{K}_{\mathrm{H}_2\mathrm{O}}/\sqrt{{K}_{\mathrm{H}}})f}_{\mathrm{H}_2{\mathrm{O}}}\right]} \end{split} $$ (6) 模拟中合成反应器选用了等温管式反应器——RPlug型反应器,该反应器遵从Langmuir-Hinshelwood-Hougen-Watson(LHHW)动力学模型。LHHW模型的内置表达式如公式(7)所示。
$$ r=\frac{k_{\mathrm{f}}\cdot D}{A} $$ (7) 式中:
$ {k}_\mathrm{f} $ ——动力学因子;
$ {D} $ ——驱动力表达式;
$ {A} $ ——吸附项。
动力学因子可以通过阿累尼乌斯公式(8)来表示:
$$ k_{\mathrm{f}}=K{{\mathrm{e}}}^{-{E}_{{\mathrm{a}}}/{\mathrm{R}}T} $$ (8) 式中:
$ K $ ——前因子;
$ {E}_{{\mathrm{a}}} $ ——活化能;
$ T $ ——反应温度;
$ {\mathrm{R}} $ ——摩尔气体常数,为8.31 J/(mol·K)。
甲醇合成反应的动力学因子关键参数如表1所示。
表 1 动力学因子中各参数的取值
Table 1. Parameter choice of kinetic factors
反应 K Ea/[J·(kmol)−1] 1 4.063 8×10−6 1.169 5×107 2 9.042 1×108 1.128 6×108 3 1.518 8×10−33 2.660 1×108 驱动力表达式为对应速率方程的分子,可以写成公式(9)~公式(11):
$$ 反应A: {K}_{\mathrm{C}\mathrm{O}}{f}_{\mathrm{C}\mathrm{O}}{f}_{{\mathrm{H}}_2}^{\tfrac{3}{2}}-\frac{{K}_{\mathrm{C}\mathrm{O}}}{{K}_{A}}{f}_{\mathrm{C}\mathrm{H}_3\mathrm{O}\mathrm{H}}{f}_{{\mathrm{H}}_2}^{-\tfrac{1}{2}}\left[{Pa}^{3/2}\right] $$ (9) $$ 反应B: {K}_{\mathrm{C}\mathrm{O}_2}{f}_{\mathrm{C}\mathrm{O}_2}{f}_{\mathrm{H}_2}-\frac{{K}_{\mathrm{C}\mathrm{O}_2}}{{K}_{B}}{f}_{\mathrm{H}_2\mathrm{O}}{f}_{\mathrm{C}\mathrm{O}}\left[Pa\right] $$ (10) $$ 反应C: {K}_{\mathrm{C}\mathrm{O}_2}{f}_{\mathrm{C}\mathrm{O}_2}{f}_{{\mathrm{H}}_2}^{\frac{3}{2}}-{\frac{{K}_{C\mathrm{O}_2}}{{K}_{C}}{f}_{\mathrm{H}_2\mathrm{O}}}f_{\mathrm{C}\mathrm{H}_3\mathrm{O}\mathrm{H}}\left[{Pa}^{3/2}\right] $$ (11) 驱动力表达式中的驱动力常数项$ K $,可以由对数形式的公式(12)来表示。
$$ \mathrm{ln}\left(K\right)=A + \frac{B}{T} $$ (12) 同一反应的正反应和逆反应的驱动力常数项$ K $中A、B参数的取值如表2所示。
表 2 驱动力常数项系数中各参数的取值
Table 2. Parameter choice of driving force constant terms and coefficients
正反应 逆反应 A B A B −23.20 14 225 28.895 2 385 −22.48 9 777 −28.120 15 062 −22.48 9 777 23.974 3 222 吸附项是速率方程公式(4)~ 公式(6)的分母,3个反应的吸附项是相同的,均可表示为公式(13)。
$$ \left(1+{K}_{\mathrm{C}\mathrm{O}}{f}_{\mathrm{C}\mathrm{O}}+{K}_{\mathrm{C}\mathrm{O}_2}{f}_{\mathrm{C}\mathrm{O}_2}\right) \left[\sqrt{{f}_{\mathrm{H}_2}}+\left({K}_{\mathrm{H}_2\mathrm{O}}/\sqrt{{K}_{\mathrm{H}}}\right)f_{\mathrm{H}_2\mathrm{O}}\right] $$ (13) 另外,根据进料量确定反应器管束为2 600个,催化剂中重量为2 776.5 kg。
由于甲醇合成反应单程转化率低,反应器出口产物中除甲醇外还有大量未反应气体和其他气体产物。因此,反应器出口产物首先经过冷凝器冷却至30 ºC,进入高压闪蒸罐内分离成气相和含甲醇液相,气相产物除少量作为驰放气排出,大部分压缩至5 MPa后成为循环气,液相进入低压闪蒸罐内再次进行气液分离,进一步除去未反应气体和其他气体产物。低压闪蒸罐出口气相与高压闪蒸罐的气相合为一股,压缩至5 MPa后成为循环气,进入合成反应器前的混合器与H2气源、CO2气源合成一股,重新进入反应器反应。低压闪蒸罐出口液相即为粗甲醇产物,粗甲醇组成简单,基本为甲醇和水。
-
甲醇合成工艺关键物流模拟结果如表3所示,表中数字1~11与图1中数字1~11位置对应。驰放气按照鲁奇工艺选取,驰放比例为0.75%。在H2气源和CO2气源的进料量分别为7 500 kg/h和54 975 kg/h时,CH3OH产量(数字10对应位置)为38 226.94 kg/h,质量分数为62.85%,碳的总转化率达到了89.5%。考虑年运行8 000 h,甲醇生产规模达30万t/a。
表 3 甲醇合成工艺关键物流模拟结果
Table 3. Key stream simulation results of methanol synthesis process
参数 1 2 3 4 5 6 7 8 9 10 11 温度/℃ 25.00 25.00 250.00 30.00 30.00 30.00 30.00 42.32 30.00 30.00 30.00 压力/MPa 5.00 5.00 5.00 5.00 4.50 4.50 4.50 5.00 1.00 1.00 4.50 摩尔流量/(kmol·h−1) 3 720.46 1 249.15 27 135.70 24 748.65 22 332.72 2 415.93 22 165.23 22 166.09 1.80 2 414.13 167.50 H2 3 720.46 0.00 21 467.83 17 882.76 17 882.19 0.58 17 748.07 17 747.37 0.53 0.05 134.12 CO 0.00 0.00 599.17 603.66 603.63 0.04 599.10 599.17 0.03 0.01 4.53 CO2 0.00 1 249.15 4 989.52 3 791.50 3 767.15 24.35 3 738.90 3 740.36 1.22 23.13 28.25 H2O 0.00 0.00 12.31 1 210.33 12.40 1 197.93 12.31 12.31 0.00 1 197.92 0.09 CH3OH 0.00 0.00 66.87 1 260.39 67.35 1 193.04 66.85 66.87 0.02 1 193.02 0.51 摩尔分数H2 1.000 0 0.000 0 0.791 1 0.722 8 0.800 7 0.000 2 0.800 7 0.800 7 0.293 4 0.000 0 0.800 7 摩尔分数CO 0.000 0 0.000 0 0.022 1 0.024 4 0.027 0 0.000 0 0.027 0 0.027 0 0.017 0 0.000 0 0.027 0 摩尔分数CO2 0.000 0 1.000 0 0.183 9 0.153 2 0.168 7 0.010 1 0.168 7 0.168 7 0.674 9 0.009 6 0.168 7 摩尔分数H2O 0.000 0 0.000 0 0.000 5 0.048 9 0.000 6 0.495 9 0.000 6 0.000 6 0.002 3 0.496 2 0.000 6 摩尔分数CH3OH 0.000 0 0.000 0 0.002 5 0.050 9 0.003 0 0.493 8 0.003 0 0.003 0 0.012 4 0.494 2 0.003 0 质量流量/(kg·h−1) 7 500.00 54 975.00 282 011.80 282 011.80 221 129.40 60 882.34 219 470.90 219 536.75 56.27 60 826.08 1 658.47 H2 7 500.00 0.00 43 276.57 36 049.51 36 048.34 1.16 35 777.98 35 776.57 1.07 0.10 270.36 CO 0.00 0.00 16 783.07 16 908.86 16 907.86 1.01 16 781.05 16 783.07 0.86 0.15 126.81 CO2 0.00 54 975.00 219 587.60 166 863.20 165 791.70 1 071.53 164 548.30 164 612.64 53.55 1 017.98 1 243.44 H2O 0.00 0.00 221.85 21 804.43 223.45 21 580.98 221.77 221.85 0.08 21 580.91 1.68 CH3OH 0.00 0.00 2 142.62 40 385.73 2 158.07 38 227.66 2 141.89 2 142.62 0.72 38 226.94 16.19 质量分数H2 1.000 0 0.000 0 0.153 5 0.127 8 0.163 0 0.000 0 0.163 0 0.163 0 0.019 0 0.000 0 0.163 0 质量分数CO 0.000 0 0.000 0 0.059 5 0.060 0 0.076 5 0.000 0 0.076 5 0.076 4 0.015 3 0.000 0 0.076 5 质量分数CO2 0.000 0 1.000 0 0.778 6 0.591 7 0.749 8 0.017 6 0.749 8 0.749 8 0.951 7 0.016 7 0.749 8 质量分数H2O 0.000 0 0.000 0 0.000 8 0.077 3 0.001 0 0.354 5 0.001 0 0.001 0 0.001 3 0.354 8 0.001 0 质量分数CH3OH 0.000 0 0.000 0 0.007 6 0.143 2 0.009 8 0.627 9 0.009 8 0.009 8 0.012 7 0.628 5 0.009 8 -
甲醇产量在反应器条件为5 MPa、220~300 ℃温度变化范围的模拟结果如图2所示。可以看出,在反应器温度为220 ℃时,甲醇质量分数约62.73%,甲醇产量为37 394 kg/h;随着温度升高,甲醇的纯度和产量升高,温度升高到250 ℃左右,甲醇的纯度和产量到达最高,质量分数为62.85%,产量为38 226 kg/h;温度再升高后,甲醇的纯度和产量均开始降低,在反应器温度为300 ℃时,甲醇质量分数约62.43%,甲醇产量为36 776 kg/h。这主要是由于甲醇合成反应,从热力学角度来说,正反应是一个放热反应,温度降低利于正反应进行;但从动力学角度来说,温度升高,分子运动加快,反应速率增加。因此,存在一个最佳反应温度,在250 ℃左右,也是目前甲醇合成工艺中通常选取的温度。
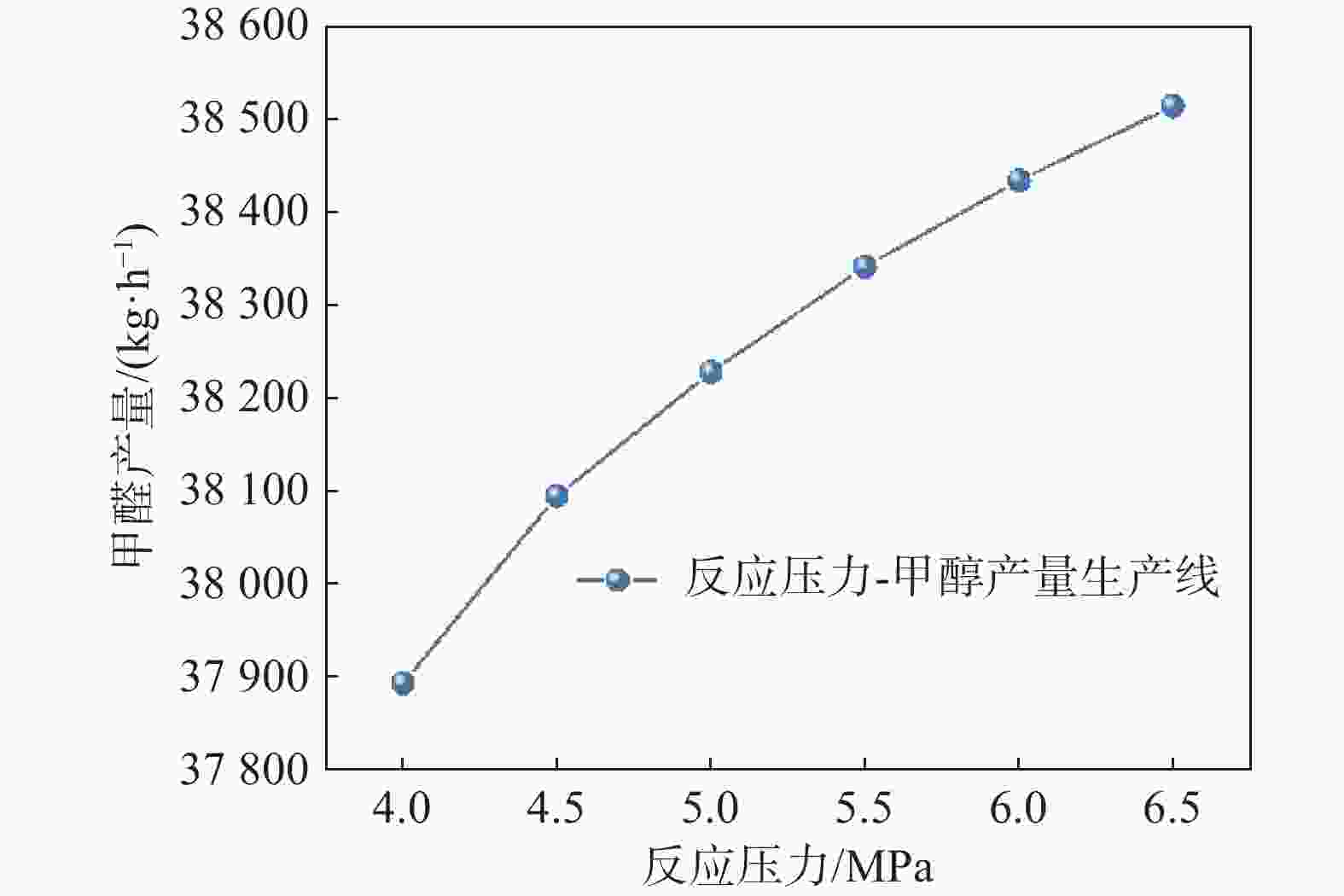
甲醇产量在反应器条件为250 ℃、 4~6.5 MPa压力变化范围的模拟结果如图3所示。由于甲醇合成反应为分子数减小的反应,增加压力会使反应向正向进行。从图3也可以看出,随着压力升高,反应器出口的甲醇的质量分数和产量也随之升高,但增长速率逐渐减缓,比如4.5~5 MPa,甲醇产量增加133.7 kg/h;5~5.5 MPa,甲醇产量增加113.2 kg/h;5.5~6 MPa,甲醇产量增加93.1 kg/h。而压力升高,压缩机功耗随之势必会增加,另外考虑甲醇合成与电解水制氢直接结合,5 MPa的电解水制氢产物压力是目前国产质子膜电解水制氢工艺里可达到的最大压力。因此,甲醇合成器选取5 MPa为较合理的参数选择。
-
固定H2进料量7 500 kg/h,在CO2进料量变化,进料比为6~8.7时,甲醇产量的变化结果如表4所示。
表 4 不同H2/CO2进料比下的甲醇产量
Table 4. Methanol yield under different H2/CO2 feed ratios
H2/(kg·h−1) CO2/(kg·h−1) 进料比 甲醇产量/(kg·h−1) 7 500 45 000 6.0 32 525.78 7 500 47 250 6.3 34 130.90 7 500 49 500 6.6 35 686.52 7 500 51 750 6.9 37 078.29 7 500 54 000 7.2 38 025.43 7 500 54 975 7.33 38 226.94 7 500 56 250 7.5 38 399.76 7 500 58 500 7.8 38 453.77 7 500 60 750 8.1 38 364.57 7 500 63 000 8.4 38 236.43 7 500 65 250 8.7 38 094.35 可以看出,甲醇产量随进料比增加,呈现先增后减的趋势,但均可保持较高的甲醇产量。进料比在7.8左右,甲醇产量达到最高,约38 453.8 kg/h,进料比再增加后,产量随之降低。根据CO2与H2合成甲醇的化学反应式计算,CO2与H2的进料比为7.33左右,反应正好完成,与模拟得到的最佳进料比7.8接近。因此,甲醇反应器在启停或波动期间,进料比可略有波动,当反应器稳定运行时,进料比控制在7.8左右,甲醇产量最优。
-
随着“双碳”政策的不断推进和深化,可再生能源电力成本降低,氢能应用规模化和市场逐渐成熟,通过电解水技术制取绿氢将是未来低碳经济的主流方向,成为H2的主要来源。电解水制氢是通过电能使电解槽内水分子在电极上发生电化学反应,目前商业化的水电解制氢主要是碱性电解水制氢和质子交换膜制氢技术。对于碱性制氢装置来说,经过电解槽和氢氧分离器后,H2纯度可达到99.8%;对于质子膜制氢装置来说,经过电解槽和氢氧分离器后,H2纯度可达到99.9%。2种制氢装置均要经过H2干燥装置,H2干燥装置主要是除去H2中的水分,将H2纯度处理到99.99%以上。
电解水制氢通常采用变温吸附工艺干燥提纯,分子筛对水分的吸附达到平衡后,再利用H2对分子筛进行再生,再生温度约170 ℃。对于7 500 kg/h的H2而言,99.8%~99.9%的H2相当于含水量75~150 kg/h。
根据表5不同含水率对应的甲醇纯度和产量表可以看出,H2的含水量对甲醇的产量有一定的影响,每增加100 kg/h的含水量,甲醇质量分数降低约0.1%,产量变化仅为几kg/h数量级,基本可忽略不计。因此,电解水氢气产物的含水量对甲醇的纯度和产量影响很小,而取消H2干燥装置,可以减少约8 000万元的设备费用,同时还可减少再生用的氢气损耗,使得制氢和新能源的跟随性更好,启动速度加快。那么,电解水得到的H2不经过干燥处理,直接与甲醇合成工艺结合是可行的,且对甲醇产量基本无影响。
表 5 不同含水量对应的甲醇纯度和产量表
Table 5. Methanol purity and yield under different water contents
H2/
(kg·h−1)CO2/
(kg·h−1)H2O/
(kg·h−1)甲醇质量分数 甲醇产量/
(kg·h−1)7 500 54 975 600 0.622 402 38 212.37 7 500 54 975 500 0.623 413 38 213.63 7 500 54 975 400 0.624 419 38 216.62 7 500 54 975 300 0.625 419 38 218.61 7 500 54 975 200 0.626 404 38 217.91 7 500 54 975 100 0.627 411 38 221.97 -
本文通过流程模拟对CO2加氢催化制甲醇工艺系统进行了分析,确定了关键工艺参数的选取依据,探究了甲醇合成与电解水结合的可行性。在合成反应器温度、压力分别为250 ℃、5 MPa的条件下,模拟流程H2和CO2的进料量分别为7 500 kg/h和54 975 kg/h,CO2/H2进料比为7.33,CH3OH产量可达38 226.94 kg/h,碳的总转化率为89.5%。目前甲醇合成工艺中通常选取的反应器温度为250 ℃,是最佳合成温度。考虑与电解水工艺的结合,5 MPa的反应器压力是合理的压力选择值。甲醇合成系统稳定运行时,CO2/H2进料比控制在7.8左右,甲醇产量最优,与化学计量数的进料比相差不大。电解水得到的H2不经过干燥处理,直接与甲醇合成工艺结合是可行的,可简化工艺,且对甲醇产量基本无影响。
根据全球碳中和战略的发展要求,新能源电力电解水制氢结合碳捕集技术生产甲醇是重要发展趋势。该技术目前面临的主要挑战在于波动性的新能源电力导致的氢气原料供应波动性如何匹配下游稳定的合成甲醇工艺。此外,高压电解水制氢、甲醇合成催化剂等也是新能源制氢耦合CO2加氢合成甲醇工艺研究的重要方向。随着风电、光电等可再生能源发电成本的下降及甲醇合成适应波动性氢气原料波动技术的发展,新能源制氢耦合CO2加氢合成甲醇工艺是具有应用前景的甲醇合成技术。
System Analysis of Methanol Synthesis by Carbon Dioxide Hydrogenation
-
摘要:
目的 二氧化碳捕集、利用和封存是实现全球温室气体净零排放的重要举措。二氧化碳加氢催化合成甲醇是碳的有效利用方式之一,将二氧化碳转化为重要燃料、化工产品甲醇,还可与电解水制氢结合,将产物甲醇作为氢气的储存载体。 方法 通过Aspen Plus模拟软件构建二氧化碳加氢催化制甲醇工艺模型,对于30万t/a的甲醇生产规模,考虑氢源来自电解水制氢,详细分析了温度、压力、二氧化碳/氢气进料比对甲醇产量的影响。 结果 模拟计算结果表明:合成温度为250 ℃,二氧化碳/氢气进料比为7.33时,甲醇产量最高;考虑直接与电解水过程结合,合成压力选取5 MPa是合理的;氢气的含水量对甲醇的产量有一定影响,原料氢气每增加100 kg/h的含水量,甲醇产量仅降低0.1%。 结论 通过模拟确定了二氧化碳加氢合成甲醇系统关键工艺参数的选取依据,证明了电解水得到的氢气不经过干燥、压缩处理,直接与甲醇合成工艺结合的可行性,新能源制氢耦合二氧化碳加氢合成甲醇工艺是具有应用前景的甲醇合成技术。 Abstract:Introduction Carbon dioxide capture, utilization and storage is an important measure to achieve the goal of net zero greenhouse gas emission. The synthesis of methanol by carbon dioxide hydrogenation is one of the effective ways to use carbon, which can not only convert CO2 into methanol, an valuable fuel and chemical product, but also combine with producing hydrogen by electrolytic water, making methanol become the storage carrier of hydrogen. Method The methanol producing process by carbon dioxide hydrogenation was modelled by simulation software Aspen Plus. For the methanol production scale of 300,000 t/a, the hydrogen producing by water electrolysis was considered as the hydrogen source, and the influence of temperature, pressure and CO2/H2 feed ratio on methanol yield was analyzed in detail. Result The simulation results show the methanol yield is the highest when the synthesis temperature is around 250 °C and the CO2/H2 feed ratio is 7.33. Considering the direct combination with water electrolysis process, the synthesis pressure at around 5 MPa is reasonable. The water content of hydrogen has a certain effect on the methanol yield. The methanol yield only reduces 0.1 percent with the water content increase 100 kg/h in the raw H2. Conclusion The simulation determined the selection basis of key process parameters of methanol synthesis system by carbon dioxide hydrogenation. In addition, the feasibility of directly combining H2 obtained from water electrolysis with methanol synthesis process without drying and compression treatment is proved. In conclusion, hydrogen production from renewable sources combined with methanol synthesis by carbon dioxide hydrogenation is a technology with application prospect. -
Key words:
- methanol /
- methanol synthesis /
- carbon dioxide /
- CO2 to methanol /
- hydrogen
-
表 1 动力学因子中各参数的取值
Tab. 1. Parameter choice of kinetic factors
反应 K Ea/[J·(kmol)−1] 1 4.063 8×10−6 1.169 5×107 2 9.042 1×108 1.128 6×108 3 1.518 8×10−33 2.660 1×108 表 2 驱动力常数项系数中各参数的取值
Tab. 2. Parameter choice of driving force constant terms and coefficients
正反应 逆反应 A B A B −23.20 14 225 28.895 2 385 −22.48 9 777 −28.120 15 062 −22.48 9 777 23.974 3 222 表 3 甲醇合成工艺关键物流模拟结果
Tab. 3. Key stream simulation results of methanol synthesis process
参数 1 2 3 4 5 6 7 8 9 10 11 温度/℃ 25.00 25.00 250.00 30.00 30.00 30.00 30.00 42.32 30.00 30.00 30.00 压力/MPa 5.00 5.00 5.00 5.00 4.50 4.50 4.50 5.00 1.00 1.00 4.50 摩尔流量/(kmol·h−1) 3 720.46 1 249.15 27 135.70 24 748.65 22 332.72 2 415.93 22 165.23 22 166.09 1.80 2 414.13 167.50 H2 3 720.46 0.00 21 467.83 17 882.76 17 882.19 0.58 17 748.07 17 747.37 0.53 0.05 134.12 CO 0.00 0.00 599.17 603.66 603.63 0.04 599.10 599.17 0.03 0.01 4.53 CO2 0.00 1 249.15 4 989.52 3 791.50 3 767.15 24.35 3 738.90 3 740.36 1.22 23.13 28.25 H2O 0.00 0.00 12.31 1 210.33 12.40 1 197.93 12.31 12.31 0.00 1 197.92 0.09 CH3OH 0.00 0.00 66.87 1 260.39 67.35 1 193.04 66.85 66.87 0.02 1 193.02 0.51 摩尔分数H2 1.000 0 0.000 0 0.791 1 0.722 8 0.800 7 0.000 2 0.800 7 0.800 7 0.293 4 0.000 0 0.800 7 摩尔分数CO 0.000 0 0.000 0 0.022 1 0.024 4 0.027 0 0.000 0 0.027 0 0.027 0 0.017 0 0.000 0 0.027 0 摩尔分数CO2 0.000 0 1.000 0 0.183 9 0.153 2 0.168 7 0.010 1 0.168 7 0.168 7 0.674 9 0.009 6 0.168 7 摩尔分数H2O 0.000 0 0.000 0 0.000 5 0.048 9 0.000 6 0.495 9 0.000 6 0.000 6 0.002 3 0.496 2 0.000 6 摩尔分数CH3OH 0.000 0 0.000 0 0.002 5 0.050 9 0.003 0 0.493 8 0.003 0 0.003 0 0.012 4 0.494 2 0.003 0 质量流量/(kg·h−1) 7 500.00 54 975.00 282 011.80 282 011.80 221 129.40 60 882.34 219 470.90 219 536.75 56.27 60 826.08 1 658.47 H2 7 500.00 0.00 43 276.57 36 049.51 36 048.34 1.16 35 777.98 35 776.57 1.07 0.10 270.36 CO 0.00 0.00 16 783.07 16 908.86 16 907.86 1.01 16 781.05 16 783.07 0.86 0.15 126.81 CO2 0.00 54 975.00 219 587.60 166 863.20 165 791.70 1 071.53 164 548.30 164 612.64 53.55 1 017.98 1 243.44 H2O 0.00 0.00 221.85 21 804.43 223.45 21 580.98 221.77 221.85 0.08 21 580.91 1.68 CH3OH 0.00 0.00 2 142.62 40 385.73 2 158.07 38 227.66 2 141.89 2 142.62 0.72 38 226.94 16.19 质量分数H2 1.000 0 0.000 0 0.153 5 0.127 8 0.163 0 0.000 0 0.163 0 0.163 0 0.019 0 0.000 0 0.163 0 质量分数CO 0.000 0 0.000 0 0.059 5 0.060 0 0.076 5 0.000 0 0.076 5 0.076 4 0.015 3 0.000 0 0.076 5 质量分数CO2 0.000 0 1.000 0 0.778 6 0.591 7 0.749 8 0.017 6 0.749 8 0.749 8 0.951 7 0.016 7 0.749 8 质量分数H2O 0.000 0 0.000 0 0.000 8 0.077 3 0.001 0 0.354 5 0.001 0 0.001 0 0.001 3 0.354 8 0.001 0 质量分数CH3OH 0.000 0 0.000 0 0.007 6 0.143 2 0.009 8 0.627 9 0.009 8 0.009 8 0.012 7 0.628 5 0.009 8 表 4 不同H2/CO2进料比下的甲醇产量
Tab. 4. Methanol yield under different H2/CO2 feed ratios
H2/(kg·h−1) CO2/(kg·h−1) 进料比 甲醇产量/(kg·h−1) 7 500 45 000 6.0 32 525.78 7 500 47 250 6.3 34 130.90 7 500 49 500 6.6 35 686.52 7 500 51 750 6.9 37 078.29 7 500 54 000 7.2 38 025.43 7 500 54 975 7.33 38 226.94 7 500 56 250 7.5 38 399.76 7 500 58 500 7.8 38 453.77 7 500 60 750 8.1 38 364.57 7 500 63 000 8.4 38 236.43 7 500 65 250 8.7 38 094.35 表 5 不同含水量对应的甲醇纯度和产量表
Tab. 5. Methanol purity and yield under different water contents
H2/
(kg·h−1)CO2/
(kg·h−1)H2O/
(kg·h−1)甲醇质量分数 甲醇产量/
(kg·h−1)7 500 54 975 600 0.622 402 38 212.37 7 500 54 975 500 0.623 413 38 213.63 7 500 54 975 400 0.624 419 38 216.62 7 500 54 975 300 0.625 419 38 218.61 7 500 54 975 200 0.626 404 38 217.91 7 500 54 975 100 0.627 411 38 221.97 -
[1] BP. BP世界能源展望2023 [M]. 北京: BP中国对外事务部, 2023. BP. Launch of BP energy outlook 2023 edition [M]. Beijing: Ministry of Foreign Affairs of BP China, 2023. [2] BP. BP世界能源统计年鉴2022 [M]. 北京: BP中国对外事务部, 2022. BP. BP statistical review of world energy 2022 edition [M]. Beijing: Ministry of Foreign Affairs of BP China, 2022. [3] IEA. CO2 emissions in 2022 [R]. Paris: IEA, 2023. [4] 郭嘉懿, 何育荣, 马晶晶, 等. 二氧化碳催化加氢制甲醇研究进展 [J]. 洁净煤技术, 2023, 29(4): 49-64. DOI: 10.13226/j.issn.1006-6772.RM22092601. GUO J Y, HE Y R, MA J J, et al. Research progress on catalytic hydrogenation of carbon dioxide to methanol [J]. Clean coal technology, 2023, 29(4): 49-64. DOI: 10.13226/j.issn.1006-6772.RM22092601. [5] ZHONG J W, YANG X F, WU Z L, et al. State of the art and perspectives in heterogeneous catalysis of CO2 hydrogenation to methanol [J]. Chemical society reviews, 2020, 49(5): 1385-1413. DOI: 10.1039/c9cs00614a. [6] LEONZIO G. State of art and perspectives about the production of methanol, dimethyl ether and syngas by carbon dioxide hydrogenation [J]. Journal of CO2 utilization, 2018, 27: 326-354. DOI: 10.1016/j.jcou.2018.08.005. [7] 李庆勋, 王宗宝, 娄舒洁, 等. 二氧化碳加氢制甲醇研究进展 [J]. 现代化工, 2019, 39(5): 19-23. DOI: 10.16606/j.cnki.issn0253-4320.2019.05.005. LI Q X, WANG Z B, LOU S J, et al. Research progress in methanol production from carbon dioxide hydrogenation [J]. Modern chemical industry, 2019, 39(5): 19-23. DOI: 10.16606/j.cnki.issn0253-4320.2019.05.005. [8] ATSONIOS K, PANOPOULOS K D, KAKARAS E. Thermocatalytic CO2 hydrogenation for methanol and ethanol production: process improvements [J]. International journal of hydrogen energy, 2016, 41(2): 792-806. DOI: 10.1016/j.ijhydene.2015.12.001. [9] KISS A A, PRAGT J J, VOS H J, et al. Novel efficient process for methanol synthesis by CO2 hydrogenation [J]. Chemical engineering journal, 2016, 284: 260-269. DOI: 10.1016/j.cej.2015.08.101. [10] 郑可昕, 高啸天, 范永春, 等. 支撑绿氢大规模发展的氨、甲醇技术对比及应用发展研究 [J]. 南方能源建设, 2023, 10(3): 63-73. DOI: 10.16516/j.gedi.issn2095-8676.2023.03.007. ZHENG K X, GAO X T, FAN Y C, et al. Comparison and application prospects of ammonia and methanol technologies supporting large-scale development of green hydrogen energy [J]. Southern energy construction, 2023, 10(3): 63-73. DOI: 10.16516/j.gedi.issn2095-8676.2023.03.007. [11] NYÁRI J. Techno-economic feasibility study of a methanol plant using carbon dioxide and hydrogen [D]. Helsinki: Aalto University, 2018. [12] 陈升华. 2021-2022年度中国甲醇行业市场分析报告(上) [J]. 广州化工, 2022, 50(3): 1-6. CHEN S H. China methanol industry market analysis report between 2021-2022 (Part 1) [J]. Guangzhou chemical industry, 2022, 50(3): 1-6. [13] 郑伟中. 氮肥协会顾理事长针对氮肥、甲醇行业碳减排、碳中和的讲话摘要 [J]. 氮肥与合成气, 2021, 49(9): 54. ZHENG W Z. The president of the nitrogen fertilizer association for nitrogen fertilizer, methanol industry carbon reduction, carbon neutral speech abstract [J]. Nitrogenous fertilizer & syngas, 2021, 49(9): 54. [14] LI S Z, WANG Y, YANG B, et al. A highly active and selective mesostructured Cu/AlCeO catalyst for CO2 hydrogenation to methanol [J]. Applied catalysis a: general, 2019, 571: 51-60. DOI: 10.1016/j.apcata.2018.12.008. [15] XIONG S H, LIAN Y, XIE H, et al. Hydrogenation of CO2 to methanol over Cu/ZnCr catalyst [J]. Fuel, 2019, 256: 115975. DOI: 10.1016/j.fuel.2019.115975. [16] WANG Y H, GAO W G, LI K Z, et al. Strong evidence of the role of H2O in affecting methanol selectivity from CO2 hydrogenation over Cu-ZnO-ZrO2 [J]. Chem, 2020, 6(2): 419-430. DOI: 10.1016/j.chempr.2019.10.023. [17] 马晓锋, 张舒涵, 何勇, 等. PEM电解水制氢技术的研究现状与应用展望 [J]. 太阳能学报, 2022, 43(6): 420-427. DOI: 10.19912/j.0254-0096.tynxb.2022-0360. MA X F, ZHANG S H, HE Y, et al. Research status and application prospect of PEM electrolysis water technology for hydrogen production [J]. Acta energiae solaris sinica, 2022, 43(6): 420-427. DOI: 10.19912/j.0254-0096.tynxb.2022-0360. [18] MILLER H A, BOUZEK K, HNAT J, et al. Green hydrogen from anion exchange membrane water electrolysis: a review of recent developments in critical materials and operating conditions [J]. Sustainable energy & fuels, 2020, 4(5): 2114-2133. DOI: 10.1039/C9SE01240K. [19] TENHUMBERG N, BÜKER K. Ecological and economic evaluation of hydrogen production by different water electrolysis technologies [J]. Chemie ingenieur technik, 2020, 92(10): 1586-1595. DOI: 10.1002/cite.202000090. [20] 林海周, 罗志斌, 裴爱国, 等. 二氧化碳与氢合成甲醇技术和产业化进展 [J]. 南方能源建设, 2020, 7(2): 14-19. DOI: 10.16516/j.gedi.issn2095-8676.2020.02.002. LIN H Z, LUO Z B, PEI A G, et al. Technology and industrialization progress on methanol synthesis from carbon dioxide and hydrogen [J]. Southern energy construction, 2020, 7(2): 14-19. DOI: 10.16516/j.gedi.issn2095-8676.2020.02.002. -





 下载:
下载: